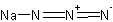Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
натрия азид
Синонимы и иностранные названия:
sodium azide (англ.)
Название вещества с нормальным (не справочным) порядком слов русского языка:
азид натрияТип вещества:
неорганическое
Внешний вид:
бел. тригональные кристаллыБрутто-формула (по системе Хилла для органических веществ):
N3NaФормула в виде текста:
NaN3Молекулярная масса (в а.е.м.): 65,01
Температура разложения (в °C):
440 (в азоте или в аргоне) [Лит.]
Продукты термического разложения:
натрий; азот; Растворимость (в г/100 г растворителя или характеристика):
аммиак жидкий: легко растворим [Лит.]
ацетон: практически не растворим [Лит.]
бензол: 0,1 (80,1°C) [Лит.]
вода: 27,6 (-15,1°C) [Лит.]
вода: 38,9 (0°C) [Лит.]
вода: 40,8 (20°C) [Лит.]
вода: 55,3 (100°C) [Лит.]
гексан: практически не растворим [Лит.]
гидроксид натрия 50% водный раствор: 2 (17°C) [Лит.]
диэтиловый эфир: не растворим [Лит.]
метанол: 3,14 (25°C) [Лит.]
тетрахлорметан: практически не растворим [Лит.]
трихлорэтилен: практически не растворим [Лит.]
хлороформ: практически не растворим [Лит.]
циклогексан: практически не растворим [Лит.]
этанол: 0,28 (0°C) [Лит.]
этанол: 0,58 (78°C) [Лит.]
этанол абсолютный: 0,315 (16°C) [Лит.]
этилацетат: практически не растворим [Лит.]
Плотность:
1,85 (20°C, г/см3, состояние вещества - кристаллы)
Некоторые числовые свойства вещества:
Летальная доза для 100% животных (ЛД100, мг/кг): 47 (крысы, подкожно)
Летальная доза для 100% животных (ЛД100, мг/кг): 49 (крысы, интратрахеально)
Летальная доза для 100% животных (ЛД100, мг/кг): 30 (мыши, подкожно)
Минимальная летальная доза (МЛД, мг/кг): 44 (крысы, подкожно)
Минимальная летальная доза (МЛД, мг/кг): 20 (мыши, подкожно)
Метод получения 1:
Источник информации: Багал Л.И. Химия и технология инициирующих взрывчатых веществ. - М., 1975 стр. 173Для получения азида натрия помещали молекулярную смесь гидразин-гидрата и натриевой щелочи (1,5 л) в сухую пятилитровую банку с пришлифованной пробкой. Затем смесь охлаждали льдом, а когда температура понижалась до 0—5°С, наливали тонкой струей, перемешивая стеклянной палочкой, 250 мл этилнитрита, после чего быстро приливали 1,5 л эфира, закрывали банку пробкой, несколько раз встряхивали (осторожно приоткрывая банку после каждого встряхивания) и оставляли смесь стоять 12 ч во льду и затем еще 12 ч при нормальной температуре. Азид натрия выделялся при этом в виде белой мелкокристаллической массы. Жидкость с осадка сливали в воронку Бюхнера, а остаток промывали декантацией смесью спирта с эфиром, переносили в воронку, отсасывали, промывали два раза спиртом и 2—3 раза чистым эфиром. После этого азид натрия сушили и получали продукт с содержанием азида натрия от 93 до 96% (в зависимости от степени чистоты гидразинсульфата). Выход азида натрия на гидразин составлял 90—95%.
Метод получения 2:
Источник информации: Журнал органической химии. - 1997. - №12 стр. 1839К раствору 8,35 г (0,05 моль) 1-нитрозо-1,2-бис-(2-цианэтил)гидразина в 50 мл этанола добавляли при перемешивании 4 г (0,1 моль) едкого натра. После перемешивания в течение 3 ч выпавший в осадок азид натрия отфильтровали, промыли этанолом, сушили на воздухе.
Выход 1,8 г (55%).
Способы получения:
- Действие оксида азота (I) на расплав амида натрия при 200-220°С. Полученный плав растворяют в воде и концентрируют упариванием в вакууме, при охлаждении выпадает азид натрия. Это промышленный метод получения азида натрия. [Лит.]
2NaNH2 + N2O → NaN3 + NH3 + NaOH
- Реакцией нитрата натрия с амидом натрия под давлением в жидком аммиаке при температуре 97°С. [Лит.]
- Реакцией азотистоводородной кислоты с гидроксидом натрия. [Лит.]
- Реакцией гидразина с дифенилнитрозамином и гидроксидом натрия в спиртовой среде. (выход 70%) [Лит.]
- Щелочной гидролиз азида карбаминовой кислоты, получаемого из семикарбазида и азотистой кислоты. [Лит.]
- Действие оксида азота (I) на раствор амида натрия в жидком аммиаке под давлением. [Лит.]
- Азид натрия может быть получен реакцией нитрата натрия с амидом натрия в расплаве. Выход 60%. [Лит.1
 ]
]
NaNO3 + 3NaNH2 → NaN3 + 3NaOH + NH3
Используется для синтеза веществ:
1,5-диаминотетразол
5-азидотетразол
натрий
натрия 5-азидотетразолат
натрия тетракис(1-трет-бутилтетразол-5-ато)аурат(III)
Реакции вещества:
- В глубоком вакууме азид натрия начинает разлагаться при 275 С с образованием чистых азота и натрия. Выход 100%. [Лит.1, Лит.2
 (синтез натрия), Лит.3
(синтез натрия), Лит.3 (синтез азота), Лит.4]
(синтез азота), Лит.4]
2NaN3 → 2Na + 3N2
- При нагревании в атмосфере азота разложение азида натрия на натрий и азот, происходит при 440 С, а атмосфере аргона - при 437 C, в атмосфере гелия - при 460 С. [Лит.1]
2NaN3 → 2Na + 3N2
- Фтор реагирует с азидом натрия с образованием смеси изомеров дифтордиазинов. Выход 30%. [Лит.1]
2NaN3 + 2F2 → N2F2 + 2NaF + 2N2
- Хлордифторамин можно получить реакцией азида натрия с фтором и хлором. [Лит.1]
2NaN3 + 3F2 + Cl2 → 2NF2Cl + 2NaF + 2N2
- Азидодитиоугольную кислоту получают реакцией азида натрия с сероуглеродом с последующим подкислением продукта соляной кислотой. [Лит.1
 ]
]
NaN3 + CS2 → N3CSSNa
N3CSSNa + HCl → N3CSSH + NaCl
- Азотистоводородная кислота может быть получена реакцией азида натрия с расплавленной стеариновой кислотой. Реакция может быть остановлена охлаждением смеси ниже температуры плавления стеариновой кислоты. [Лит.1]
NaN3 + CH3(CH2)16COOH → HN3 + CH3(CH2)16COONa
- Азотистоводородную кислоту получают реакцией азида натрия с серной кислотой. [Лит.1
 ]
]
NaN3 + H2SO4 → HN3 + NaHSO4
- 2,2,4,4,6,6-Гексаазидоциклотрифосфазен был получен реакцией 2,2,4,4,6,6-гексахлорциклотрифосфазена с азидом натрия в ацетоне. [Лит.1
 ]
]
P3N3Cl6 + 6NaN3 → P3N3(N3)6 + 6NaCl
- Высокочистый азид аммония можно получить нагреванием сухих нитрата аммония и азида натрия с улавливанием сублимирующегося азида аммония. [Лит.1
 ]
]
NaN3 + NH4NO3 → NH4N3 + NaNO3
- Хлоразид можно получить подкислением водного раствора азида натрия и гипохлорита натрия уксусной кислотой при добавлении тетрахлорметана. [Лит.1
 ]
]
NaN3 + NaOCl + 2CH3COOH → ClN3 + 2CH3COONa + H2O
- При нагревании на металлической пластинке азид натрия сначала плавится, при высокой температуре слабо вспыхивает с ярко-желтым светом. При медленном нагревании выше 330 С может взорватся. Экзотермическая реакция с воздухом порошка азида натрия начинается при 400 С и достигает максимума при 460 С, в таблетках максимум разложения достигается уже при 402 С. [Лит.1, Лит.2]
4NaN3 + O2 → 2Na2O + 6N2
- Азот можно получить реакцией водного раствора азида натрия с раствором иода в водном растворе иодида калия в присутствии тиосульфата натрия. [Лит.1
 ]
]
2NaN3 + I2 → 2NaI + 3N2
- Реакцией азида натрия с тионилхлоридом в ацетонитриле при -35 С получают сульфанурхлорид. [Лит.1]
- Реакция серы с азидом натрия в гексаметилфосфаттриамиде дает гептасульфуримид. [Лит.1]
- Диазид-оксид углерода был получен выдерживанием оксида-фторида-хлорида углерода с азидом натрия в течение 4 дней при комнатной температуре в запаяной ампуле. [Лит.1]
- Этиловый эфир тетразол-5-карбоновой кислоты получают реакцией этилцианоформиата с азидом натрия. [Лит.1
 , Лит.2
, Лит.2 ]
] - При облучении рентгеновскими лучами или бомбардировке медленными нейтронами азид натрия становится коричневого цвета. [Лит.1]
Реакции, в которых вещество не участвует:
- Не взрывается от удара. [Лит.]
Свойства растворов:
1% (вес.), растворитель - вода
Плотность (г/см3) = 1,004 (20°)
2% (вес.), растворитель - вода
Плотность (г/см3) = 1,01 (20°)
4% (вес.), растворитель - вода
Плотность (г/см3) = 1,022 (20°)
6% (вес.), растворитель - вода
Плотность (г/см3) = 1,034 (20°)
8% (вес.), растворитель - вода
Плотность (г/см3) = 1,047 (20°)
10% (вес.), растворитель - вода
Плотность (г/см3) = 1,059 (20°)
12% (вес.), растворитель - вода
Плотность (г/см3) = 1,072 (20°)
14% (вес.), растворитель - вода
Плотность (г/см3) = 1,085 (20°)
16% (вес.), растворитель - вода
Плотность (г/см3) = 1,099 (20°)
18% (вес.), растворитель - вода
Плотность (г/см3) = 1,112 (20°)
20% (вес.), растворитель - вода
Плотность (г/см3) = 1,126 (20°)
22% (вес.), растворитель - вода
Плотность (г/см3) = 1,14 (20°)
24% (вес.), растворитель - вода
Плотность (г/см3) = 1,155 (20°)
30% (вес.), растворитель - вода
Плотность (г/см3) = 1,202 (20°)
Стандартный электродный потенциал:
3N2 + 2e- → 2N3-, E = -3,4 (вода, 25°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
21,3 (т)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
99,4 (т)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
70,5 (т)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
76,6 (т)Некоторые нечисловые свойства вещества:
не гигроскопичное вещество
не летуч
Летальная доза (ЛД50, в мг/кг):
45 (кролики, накожно)
45 (крысы, подкожно)
47,5 (крысы, интрахеально)
60 (крысы, накожно)
23 (мыши, подкожно)
Симптомы острого отравления:
Токсичен. На одноклеточные водоросли действует как один из наиболее мощных мутагенов, хотя уступает нитрозосоединениям. Картина отравления у теплокровных во многом сходна с вызываемой цианидами в силу сходства биохимического действия.
Симптомы отравления у животных: При введении крысам внутрибрюшинно (3-5 мг/кг веса в течение 1-5 дней) - апатия, тремор, судороги, цианоз, снижение температуры тела, резкое угнетение дыхания, кома и смерть; у выживших - выпадение шерсти, нефрит. На вскрытии - повреждение миокарда, в легких отек и кровоизлияния, вакуолизация и жировая дистрофия печени, некрозы в ткани мозга, вакуолизация митохондрий. Ультраструктурные изменения сходны с теми, которые наблюдаются при гиповитаминозе В1. При аппликации на кожу спины кроликов нарушение вестибулярной хронаксии, снижение подвижности.
Симптомы отравления у человека: После случайного приема азида натрия через 5 минут удушье и сердцебиение, через 1,5-4 ч слабость, тошнота, падение кровяного давления, сильный понос со слизью, одышка. Смерть в одном случае наступила через 40 мин, в другом - через 12 ч. На вскрытии - отек легких, многочисленные кровоизлияния в слизистые оболочки внутренних органов, отек мозга.
Лечение отравлений:
В экспериментальных условиях хороший эффект получен при предварительном введении метиленовой сини, нитрита натрия, тиосульфата натрия.
Применение вещества:
- для получения азидов тяжелых металлов [Лит.]
Источники информации:
- Багал Л.И. Химия и технология инициирующих взрывчатых веществ. - М., 1975. - С. 154-158
- Вредные вещества в промышленности: Справочник для химиков, инженеров и врачей. - 7-е изд., Т.3. - Л.: Химия, 1976. - С. 99-100
- Вредные химические вещества: Неорганические соединения элементов V-VIII групп. Справочник. - Л., 1989. - С. 25-26
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 405
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 83
- Ситтиг М. Натрий, его производство, свойства и применение. - М.: ГИЛОАНТ, 1961. - С. 220-222
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 117, 666
- Справочник химика. - 2 изд., Т. 2. - Л.-М.: Химия, 1964. - С. 132-133
- Справочник химика. - Т. 3. - М.-Л.: Химия, 1965. - С. 214, 544
- Химическая энциклопедия. - Т. 1. - М.: Советская энциклопедия, 1988. - С. 48
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер