Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
этин
Синонимы и иностранные названия:
acetylene (англ.)
ацетилен (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. газБрутто-формула (по системе Хилла для органических веществ):
C2H2Формула в виде текста:
HC≡CHМолекулярная масса (в а.е.м.): 26,04
Температура возгонки (сублимации) (в °C):
-84,1 [Лит.]
Температуры плавления под давлением (в °C):
-81 (0,17 МПа)
Растворимость (в г/100 г растворителя или характеристика):
N-метилпирролидон-2: 4,09 (20°C) [Лит.]
азот жидкий: 0,0002 (-196°C) [Лит.]
ацетон: 5,67 (0°C) [Лит.]
ацетон: 5,05 (5°C) [Лит.]
ацетон: 4,51 (10°C) [Лит.]
ацетон: 3,6 (20°C) [Лит.]
ацетон: 3,23 (25°C) [Лит.]
ацетон: 2,9 (30°C) [Лит.]
ацетон: 2,38 (40°C) [Лит.]
бензол: 0,749 (4°C) [Лит.]
вода: 0,197 (1°C) [Лит.]
вода: 0,1561 (10°C) [Лит.]
вода: 0,12 (20°C) [Лит.]
вода: 0,1006 (30°C) [Лит.]
гексаметилфосфаттриамид: 5,54 (20°C) [Лит.]
диметилацетамид: 3,22 (20°C) [Лит.]
диметилсульфоксид: 2,8 (20,3°C) [Лит.]
диметилформамид: 4,08 (20°C) [Лит.]
диметилформамид: 3,72 (25°C) [Лит.]
диметилформамид: 3 (30°C) [Лит.]
диметоксиметан: 1,39 (20°C) [Лит.]
диоксан: 2,16 (20°C) [Лит.]
диэтиловый эфир: 0,35 (20°C) [Лит.]
кислород жидкий: 0,00049 (-183°C) [Лит.]
метанол: 1,45 (25°C) [Лит.]
метиламин: растворим [Лит.]
метилацетат: 4,8 (0°C) [Лит.]
метилацетат: 3 (20°C) [Лит.]
метилацетат: 1,64 (40°C) [Лит.]
нитробензол: 0,573 (3°C) [Лит.]
тетрагидрофуран: 2,38 (20°C) [Лит.]
тетраметилмочевина: 3,27 (20°C) [Лит.]
тетрахлорметан: 0,282 (0°C) [Лит.]
тетрахлорметан: 0,225 (20°C) [Лит.]
триэтилфосфат: 2,51 (20°C) [Лит.]
уксусная кислота: растворим [Лит.]
хлорбензол: 0,4 (20°C) [Лит.]
циклогексанол: 0,963 (2,6°C) [Лит.]
этанол: 1,25 (0°C) [Лит.]
Плотность:
0,81 (-196°C, г/см3, состояние вещества - кристаллы)
0,79 (-183°C, г/см3, состояние вещества - кристаллы)
Энергии, длины и углы связей молекул вещества:
Длина связи (пм): 120,5 (C≡C)
Длина связи (пм): 105,9 (C-H)
Некоторые числовые свойства вещества:
Верхний концентрационный предел взрываемости газов, паров или пыли в воздухе (%): 81
Год открытия: 1836 (Дэви Э.)
Магнитная восприимчивость (мм3/моль): -0,0208
Нижний концентрационный предел взрываемости газов, паров или пыли в воздухе (%): 2,5
Способы получения:
- Реакция 1,1,2,2-тетрабромэтана со спиртовым раствором гидроксида калия. [Лит.]
- Электролиз фумарата или малеината натрия. [Лит.]
- Электролиз 40%-ного раствора акрилата натрия на платиновых электродах. [Лит.]
- Чистый ацетилен получается разложением суспензии ацетиленида меди раствором цианида калия. Разложение действием кислот дает более низкие выходы и побочные продукты. [Лит.]
- Реакцией бромоформа или иодоформа с цинком. [Лит.]
- Ацетилен получают в промышленности пиролизом метана при 1400 С. Выход повышается при понижении давления, разбавлении смеси водородом и быстром охлаждении смеси. Выход 7 - 44%. [Лит.1, Лит.2]
2CH4 → C2H2 + 3H2
- Ацетилен можно получать термическим распадом метана в электрической дуге. Выход 20%. [Лит.1]
2CH4 → C2H2 + 3H2
- Ацетилен можно получать в электрической дуге между графитовыми электродами в атмосфере водорода. Выход 8%. [Лит.1]
2C + H2 → C2H2
- Карбид кальция реагирует с водой со значительным выделением тепла, с образованием ацетилена и гидроксида кальция. [Лит.1, Лит.2]
CaC2 + 2H2O → Ca(OH)2 + C2H2
Используется для синтеза веществ:
1,1-ди(4-метилфенил)этан
селенофен
Реакции вещества:
- Ацетилен может взорваться при местном нагревании до 635 С при давлении 1 ат. С ростом давления температура начала взрывного разложения падает. Наличие окислов железа, кизельгура, окиси алюминия, силикагеля или древесного угля снижает температуру взрыва до 280-300 С. На твердом гидроксиде калия газофазное разложение происходит при 170 С. Взрыв также вызывается подрывом инициирующих взрывчатых веществ. Продуктами взрыва являются сажа, водород (92,8%) как примеси ацетилен (2,6%), метан (3,9%) и этилен (0,15%). [Лит.]
C2H2 → 2C + H2
- При пропускании в раствор этилмагнийбромида дает дибромид этиндиилдимагния. [Лит.]
HC≡CH + 2C2H5MgBr → 2C2H6 + BrMgC≡CMgBr
- При пропускании в аммиачный раствор солей меди(I) образует красно-фиолетовый осадок ацетиленида меди(I). [Лит.]
HC≡CH + 2[Cu(NH3)2]Cl → Cu2C2 + 2NH4Cl + 2NH3
- При пропускании над натрием при 150°С или пропускании в раствор натрия в жидком аммиаке образует ацетиленид мононатрия. [Лит.]
2HC≡CH + 2Na → 2HC≡CNa + H2
- При пропускании в аммиачный раствор солей серебра образует желтый осадок ацетиленида серебра. [Лит.]
2[Ag(NH3)2]NO3 + C2H2 → Ag2C2 + 2NH4NO3 + 2NH3
- Реагирует с амидом натрия с образованием карбида натрия и аммиака. [Лит.]
HC≡CH + 2NaNH2 → NaC≡CNa + 2NH3
- Горит ярким светящимся коптящим пламенем. Смеси с воздухом и кислородом взрывоопасны в широком диапазоне концентраций. [Лит.]
2C2H2 +5O2 → 4CO2 + 2H2O
- В электроразряде реагирует с азотом с образованием циановодорода. [Лит.]
C2H2 + N2 → 2HCN
- Присоединяет хлор сначала образуя 1,2-дихлорэтен, а затем 1,1,2,2-тетрахлорэтан. [Лит.]
C2H2 + Cl2 → ClCH=CHCl
C2H2 + 2Cl2 → Cl2CHCHCl2
- При пропускании через разбавленный водный раствор сульфата ртути(II) в присутствии серной кислоты образует ацетальдегид. [Лит.]
HC≡CH + H2O → CH3CHO
- В присутствии катализатора при избытке ацетилена он присоединяется к уксусной кислоте с образованием винилацетата. [Лит.]
HC≡CH + CH3COOH → CH2=CHOC(O)CH3
- В присутствии катализатора при избытке ацетилена он присоединяется к этиловому спирту давая этоксиэтен. [Лит.]
HC≡CH + C2H5OH → CH2=CHOC2H5
- Пропускание в тетрагидрофурановый раствор натрия и нафталина с последующим пропусканием углекислого газа дает пропиновую кислоту. (выход 20%) [Лит.]
C2H2 + CO2 → HC≡CCOOH
- Реагирует при 5°С с ацетоном в метилале в присутствии смеси чешуек гидроксида натрия и порошка гидроксида калия (3:7) с образованием 2,6-диметилгекс-3-ин-2,5-диола. (выход 90%) [Лит.]
2(CH3)2CO + C2H2 → (CH3)2C(OH)C≡CC(OH)(CH3)2
- Реагирует с водородом в присутствии катализатора (палладий на карбонате кальция дезактивированный ацетатом свинца) с образованием этена. [Лит.]
HC≡CH + H2 → CH2=CH2
- При пропускании ацетилена над пиритом при 280-310 С образуется тиофен. [Лит.]
- Реагирует со смесью оксида азота(II) и оксида азота(IV) с образованием 3,3'-бис-изоксазолила. (выход 88%) [Лит.]
- В присутствии солей меди(I) в водном солянокислом растворе димеризуется в бут-1-ен-3-ин. [Лит.]
2HC≡CH → HC≡CCH=CH2
- При 60-70°С, 15 атм, в присутствии дикарбонил-бис(трифенилфосфин)никеля тримеризуется в бензол. (выход 80%) [Лит.]
3HC≡CH → C6H6
- При 80-120°С, 10-25 атм, в тетрагидрофуране, в присутствии комплексов двухвалентного никеля тетрамеризуется в 1,3,5,7-циклооктатетраен. (выход 70%) [Лит.]
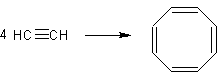
- Реагирует с аммиаком при 170-200 С, давлении 20-30 атм, в присутствии ацетата аммония с образованием 2-метил-5-этилпиридина. (выход 90%) [Лит.]
- Реагирует с первичными и вторичными аминами в присутствии ацетиленида меди под давлением при 80-100 С с образованием 3-аминобутинов-1. [Лит.]
- В присутствии воды при 60-70 С и давлении 20 атм реагирует с триметиламином с образованием гидроксида винилтриметиламмония. [Лит.]
- Реагирует при 400 С с оксидом селена(IV) с количественным образованием углекислого газа и воды. [Лит.]
- Реагирует с хлоруксусной кислотой в присутствии оксида серебра с образованием винилового эфира хлоруксусной кислоты. (выход 42%) [Лит.]
- Реагирует с толуолом в присутствии сульфата ртути(II) с образованием 1,1-бис(4-метилфенил)этана. (выход 60%) [Лит.]
- При 90 С, в присутствии октакарбонила дикобальта, под давлением 900-1000 атм, в апротонном растворителе присоединяется к угарному газу с образованием транс-бис(5-оксофурилидена-2). (выход 65%) [Лит.]
- При пиролизе при 581-697 С образует бут-1-ен-3-ин со следами бензола. [Лит.]
- Ацетилен самовоспламеняется при контакте с фтором, хлором, бромом. [Лит.1]
- Бензол может быть получен тримеризацией ацетилена над катализатором (дикарбонил-бис-трифенилфосфинникель(0)) при 60-70 С и давлении 15 атм. Выход 80%. [Лит.1]
3C2H2 → C6H6
- н-Пропилэтинилкарбинол получают реакцией масляного альдегида с ацетиленом в присутствии порошкообразного гидроксида калия в эфире. Выход 60%. Название реакции: реакция Фаворского. [Лит.1
 ]
] - Ацетиленид дилития можно получить реакцией лития с ацетиленом в жидком аммиаке, с последующим термическим разложением ацетиленида монолития. Продукт всегда содержит примесь ацетиленида монолития. [Лит.1
 ]
]
2Li + 2C2H2 → 2LiC2H + H2
2LiC2H → Li2C2 + C2H2
- Ацетилен присоединяется к этиламину в присутствии обезвоженных ацетатов кадмия и цинка в автоклаве при 120-140 С в течение 29 часов с образованием N-этилиденэтиламина. Выход 55%. [Лит.1]
C2H5NH2 + C2H2 → C2H5N=CHCH3
- Пропускание ацетилена и паров воды через гидроксид натрия нагретый до 220 С дает ацетат натрия и водород. Применение повышенного давления не требуется, хотя оно желательно для увеличения количества перерабатываемого ацетилена. Удобнее работать с давлением порядка 3,5-4,5 ат. Выход 96%. [Лит.1]
C2H2 + H2O + NaOH → CH3COONa + H2
- Ацетиленид мононатрия получают реакцией натрия с ацетиленом в жидком аммиаке. [Лит.1
 ]
]
2Na + 2C2H2 → 2NaC≡CH + H2
- Нонакарбонил дижелеза реагирует с ацетиленом при 20-25 С и давлении 20-24 атм с образованием оранжевого тропонтрикарбонилжелеза, который имеет две кристаллические формы с разными температурами плавления. Выход 28%. [Лит.1, Лит.2]
- Хлорид иода(I) реагирует с ацетиленом с образованием дииодацетилена. [Лит.1]
- Реакция калия с ацетиленом начинается уже на холоду, при длительном воздействии образуется ацетиленид монокалия. [Лит.1]
2K + 2C2H2 → 2KHC2 + H2
- Расплавленный калий практически сгорает в ацетилене с образованием карбида калия. [Лит.1]
Реакции, в которых вещество не участвует:
- Ацетилен, растворенный в ацетоне не взрывается вплоть до давления 10 ат ни от нагретой проволоки, ни от детонатора. [Лит.1]
Показатель преломления (для D-линии натрия):
1,0005 (0°C)
Давление паров (в мм рт.ст.):
0,00014 (-183°C)
Показатели диссоциации:
pKa (1) = 25 (20°C, вода)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
227,4 (г)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
209,9 (г)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
200,8 (г)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
43,93 (г)Температура самовоспламенения на воздухе (°C):
335Теплота сгорания (кДж/моль):
1305,4Спектральные свойства вещества:
Протонный магнитный резонанс (миллионные доли (м.д.)) = 1,8 (к тетраметилсилану)
Критическая температура (в °C):
35,2Критическое давление (в МПа):
6,45Критическая плотность (в г/см3):
0,23Применение вещества:
- в производстве акрилонитрила [Лит.]
- в производстве ацетальдегида [Лит.]
- в производстве винилацетата [Лит.]
- в производстве винилхлорида [Лит.]
- в производстве тетрахлорэтана [Лит.]
- для ацетиленовой сварки металлов [Лит.]
Источники информации:
- CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010. - С. 5-21
- Flick E.W. Industrial solvent handbook. - 5ed. - 1998. - С. 791 (растворимость)
- Lewis R.J. Sax's Dangerous Properties of Industrial Materials. - 11ed. - Wiley-interscience, 2004. - С. 44-45
- Milne G.W.A. Gardner's Commercially Important Chemicals. - Wiley-Interscience, 2005. - С. 9
- Seidell A. Solubilities of organic compounds. - 3ed., vol.2. - New York: D. Van Nostrand Company, 1941. - С. 71-75
- Каррер П. Курс органической химии. - Л.: ГНТИХЛ, 1960. - С. 78-82
- Корольченко А.Я., Корольченко Д.А. Пожаровзрывоопасность веществ и материалов и средства их тушения. - 2 изд, Ч.1. - М.: Ассоциация Пожнаука, 2004. - С. 198
- Миллер С.А. Ацетилен, его свойства, получение и применение. - Т.1. - Л.: Химия, 1969
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 534
- Ньюлэнд Ю., Фогт Р. Химия ацетилена. - М.: ГИИЛ, 1947
- Промышленные хлорорганические продукты: Справочник. - М.: Химия, 1978. - С. 603-604
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 126
- Рапопорт Ф.М., Ильинская А.А. Лабораторные методы получения чистых газов. - М., 1963. - С. 362-367
- Реми Г. Курс неорганической химии. - Т.1. - М., 1963. - С. 475-478
- Реутов О.А., Курц А.Л., Бутин К.П. Органическая химия. - 2-е изд., Ч.1. - М.: Бином. Лаборатория знаний, 2005. - С. 469, 474
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 56, 377
- Справочник по растворимости. - Т.1, Кн.2. - М.-Л.: ИАН СССР, 1962. - С. 1024, 1065-1071
- Химическая энциклопедия. - Т. 1. - М.: Советская энциклопедия, 1988. - С. 226-228
- Химический энциклопедический словарь. - Под ред. Кнунянц И.Л. - М.: Советская энциклопедия, 1983. - С. 62
- Щелкунов А.В., Васильева Р.Л., Кричевский Л.А. Синтез и взаимные превращения монозамещенных ацетиленов. - Алма-Ата, 1976. - С. 46-47
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер