Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
азотная кислота
Синонимы и иностранные названия:
nitric acid (англ.)
Вещество входит в группы:
соединения азота, водорода и кислорода
Тип вещества:
неорганическое
Внешний вид:
бесцветн. жидкостьКристаллические модификации, структура молекулы, цвет растворов и паров:
В твердом виде представляет собой белые кристаллы (плотность 1,52 г/см3).
Брутто-формула (по системе Хилла для органических веществ):
HNO3Формула в виде текста:
HONO2Молекулярная масса (в а.е.м.): 63,01
Температура плавления (в °C):
-41,6Температура кипения (в °C):
83Температурные константы смесей (содержание в весовых процентах):
121,9 °C (температура кипения азеотропа, давление 1 атм) азотная кислота 68,4% вода 31,6%
Растворимость (в г/100 г растворителя или характеристика):
вода: смешивается [Лит.]
дихлорметан: смешивается [Лит.]
диэтиловый эфир: растворим [Лит.]
нитроглицерин: смешивается [Лит.]
пентафторид иода: смешивается [Лит.]
Фазовая и многокомпонентная растворимость (в масс%):
азотная кислота 1%, вода 98,44%, кальция сульфат 0,56%, 25 °C [Лит.]
азотная кислота 3,92%, вода 94,904%, кальция сульфат 1,176%, 25 °C [Лит.]
азотная кислота 11,26%, вода 86,88%, кальция сульфат 1,86%, 25 °C [Лит.]
азотная кислота 2,796%, вода 97,1939%, серебра хлорид 0,0101%, 0 °C [Лит.]
азотная кислота 2,796%, вода 97,1807%, серебра хлорид 0,0233%, 25 °C [Лит.]
азотная кислота 2,796%, вода 97,178%, серебра хлорид 0,026%, 30 °C [Лит.]
азотная кислота 2,796%, вода 97,1477%, серебра хлорид 0,0563%, 40 °C [Лит.]
азотная кислота 2,796%, вода 97,095%, серебра хлорид 0,109%, 50 °C [Лит.]
азотная кислота 4,93%, вода 70,32%, свинца нитрат 24,75%, 26 °C, отделяющаяся фаза: Pb(NO3)2 [Лит.]
азотная кислота 12,96%, вода 74,82%, свинца нитрат 12,22%, 26 °C, отделяющаяся фаза: Pb(NO3)2 [Лит.]
азотная кислота 25,99%, вода 69,75%, свинца нитрат 4,26%, 26 °C, отделяющаяся фаза: Pb(NO3)2 [Лит.]
азотная кислота 50,26%, вода 49,21%, свинца нитрат 0,53%, 26 °C, отделяющаяся фаза: Pb(NO3)2 [Лит.]
азотная кислота 63,84%, вода 36,1%, свинца нитрат 0,06%, 26 °C, отделяющаяся фаза: Pb(NO3)2 [Лит.]
азотная кислота 71,35%, вода 28,64%, свинца нитрат 0,008%, 26 °C, отделяющаяся фаза: Pb(NO3)2 [Лит.]
азотная кислота 3,5%, вода 43,4%, цинка нитрат 53,1%, 25 °C, отделяющаяся фаза: Zn(NO3)2 * 6H2O [Лит.]
азотная кислота 24%, вода 34,5%, цинка нитрат 41,5%, 25 °C, отделяющаяся фаза: Zn(NO3)2 * 4H2O [Лит.]
азотная кислота 12,8%, вода 21,3%, цинка нитрат 65,9%, 25 °C, отделяющаяся фаза: Zn(NO3)2 * 2H2O [Лит.]
азотная кислота 42,1%, вода 13,3%, цинка нитрат 44,6%, 25 °C, отделяющаяся фаза: Zn(NO3)2 * 2H2O [Лит.]
азотная кислота 37,4%, вода 10,5%, цинка нитрат 52,1%, 25 °C, отделяющаяся фаза: Zn(NO3)2 * H2O [Лит.]
азотная кислота 88,8%, вода 1,3%, цинка нитрат 9,9%, 25 °C, отделяющаяся фаза: Zn(NO3)2 * H2O [Лит.]
азотная кислота 5,2%, вода 41,86%, калия нитрат 17,68%, натрия нитрат 35,26%, 25 °C, отделяющаяся фаза: NaNO3 + KNO3 [Лит.]
азотная кислота 38,98%, вода 37,13%, калия нитрат 16,74%, натрия нитрат 7,15%, 25 °C, отделяющаяся фаза: NaNO3 + KNO3 * 2HNO3 [Лит.]
азотная кислота 62,59%, вода 33,07%, калия нитрат 1,02%, натрия нитрат 3,32%, 25 °C, отделяющаяся фаза: NaNO3 + KNO3 * 2HNO3 [Лит.]
Плотность:
1,513 (20°C, г/см3, состояние вещества - жидкость)
Нормативные документы, связанные с веществом:
- ГОСТ № 701-89 "Кислота азотная концентрированная. Технические условия." (Описание документа: Азотная кислота марок А и Б.)
Метод получения 1:
Источник информации: Tetrahedron Letters. - 2001. - Vol. 42, No. 7 стр. 1388 [doi: 10.1016/S0040-4039(00)02253-X]Cмешивают 10,1 г (100 ммоль) тонкоизмельченного нитрата калия и 5,5 мл (98,8 ммоль) 96% серной кислоты. Смесь выдерживают при эффективном перемешивании в течение 1 часа при комнатной температуре в темноте с защитой от внешней влаги. Комки, которые образуются в процессе, следует тщательно разбить. Полученную таким образом бесцветную гомогенную суспензию трижды экстрагируют (перемешивание в течение 10 мин) дихлорметаном (1x30 мл и 2x20 мл), полученные экстракты объединяют и фильтруют через пористый стеклянный фильтр.
Было обнаружено, что полученный раствор (около 70 мл) содержит в среднем 1,19 М азотной кислоты (выход 83% от стехиометрии) и не содержит H2SO4 или HCl, образующегося при разложении растворителя. Кроме того, ионная хроматография и отрицательная проба c KMnO4 исключили наличие азотсодержащих продуктов в более низкой степени окисления. При необходимости полученный таким образом раствор HNO3 может быть концентрирован путем отгонки части растоврителя при атмосферном давлении.
Метод получения 2:
Источник информации: Руководство по неорганическому синтезу. - Т.2, под ред. Брауэра Г. - М.: Мир, 1985 стр. 519Чистую безводную азотную кислоту получают взаимодействием нитрата калия с концентрированной серной кислотой в вакууме водоструйного насоса.
Метод очистки или выделения из смесей 1:
Источник информации: Карякин Ю.В., Ангелов И.И. Чистые химические вещества. - М., 1974 стр. 163Для получения 99%-ной азотной кислоты смесь 1,45 л азотной кислоты (хч, пл. 1,40) и 400 г оксида фосфора(V) перегоняют из реторты через прямой холодильник. Дистиллат, окрашенный в коричнево-красный цвет окислами азота, обесцвечивают продуванием сухого и чистого воздуха.
Выход 1,8 кг.
Метод очистки или выделения из смесей 2:
Источник информации: Карякин Ю.В., Ангелов И.И. Чистые химические вещества. - М., 1974 стр. 163Перегоняют смесь 1 объема продажной азотной кислоты (пл. 1,40) и 3-5 объемов серной кислоты (пл. 1,84). Получают красную дымящую азотную кислоту.
Способы получения:
- Реакцией нитрата калия с серной кислотой. [Лит.]
KNO3 + H2SO4 → KHSO4 + HNO3
- Реакцией нитрата натрия с серной кислотой. [Лит.]
NaNO3 + H2SO4 → NaHSO4 + HNO3
Реакции вещества:
- Окисляет иодоводород на холоду давая иод и оксид азота(II). [Лит.]
6HI + 2HNO3 → 3I2 + 2NO + 4H2O
- 0,2 М азотная кислота при 0 С реагирует с железом с образованием нитрата железа(II). [Лит.]
- Кипящая кислота окисляет уголь до углекислого газа. [Лит.]
- Кипящая кислота окисляет серу в серную кислоту. [Лит.]
- Разлагается на свету или при нагревании на диоксид азота, кислород и воду. Выделяющийся диоксид азота окрашивает кислоту в желтый или красный цвет. 100% кислота медленно разлагается уже при комнатной температуре. [Лит.]
- Растворяет селен, теллур, мышьяк. [Лит.]
- Концентрированная азотная кислота окисляет сульфид свинца до сульфата свинца. [Лит.]
- Смесь азотной и фтороводородной кислот используют для растворения кремния, титана, ниобия, тантала, циркония, гафния, вольфрама, олова и их сплавов. [Лит.]
- В смеси с концентрированной соляной кислотой растворяет золото и платину. [Лит.]
- В концентрации 68% реагирует с ртутью, цинком, медью, магнием, никелем давая нитрат металла(II), оксид азота(IV) и воду. [Лит.]
- При нагревании окисляет иод, фосфор. [Лит.]
- В концентрации 30% реагирует с ртутью давая нитрат ртути(II), воду и оксид азота(II). [Лит.]
- Реагирует с металлами давая в зависимости от концентрации и активности металла нитрат аммония, водород, азот, оксид азота(I), оксид азота(II) или оксид азота(IV) в смеси друг с другом. [Лит.]
- Бензол нитруется смесью концентрированных азотной и серной кислот при 45-50 °С с образованием нитробензола. Выход 85-86%. [Лит.1]
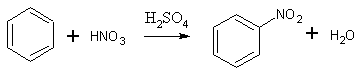
- Нитромезитилен можно получить нитрованием мезитилена дымящей азотной кислотой в присутствии активированного асканита-бентонита в среде тетрахлорметана или гексана при температуре 20-25 С. [Лит.1]
(CH3)3C6H3 + HNO3 → (CH3)3C6H2NO2 + H2O
- 3-Хлорбензальдегид нитруется смесью азотной и серной кислот при температуре от 0 до 20 С с образованием 2-нитро-5-хлорбензальдегида. Выход 80%. [Лит.1
 ]
] - Золото растворяется в смеси соляной и азотной кислот (царской водке). [Лит.1]
Au + HNO3 + 4HCl → H[AuCl4] + NO + 2H2O
- В концентрации 10-20% азотная кислота реагирует с магнием давая нитрат магния и газовую смесь с содержанием водорода до 80%. [Лит.1]
Mg + 2HNO3 (10%) → Mg(NO3)2 + H2
- В концентрации 10-20% азотная кислота реагирует с марганцем давая нитрат марганца(II) и газовую смесь с содержанием водорода до 80%. [Лит.1]
Mn + 2HNO3 (10%) → Mn(NO3)2 + H2
- Серебро реагирует с разбавленной азотной кислотой с образованием нитрата серебра и оксида азота(II). [Лит.1]
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
- Серебро растворяется в концентрированной азотной кислоте с образованием нитрата серебра и оксида азота(IV). [Лит.1]
Ag + 2HNO3 → AgNO3 + NO2 + H2O
- Ренистая кислота легко растворяется в азотной кислоте окисляясь до рениевой кислоты. [Лит.1]
- Нитрат фтора получают взаимодействием безводной азотной кислоты с фтором. Выход 70%. [Лит.1, Лит.2]
HNO3 + F2 → FONO2 + HF
- Нитрат хлора можно получить реакцией фторида хлора(I) с азотной кислотой при низкой температуре. Выход 85-95%. [Лит.1
 ]
]
ClF + HNO3 → ClNO3 + HF
- Ванадий быстро растворяется в азотной кислоте с плотностью выше 1,35 г/см3 с образованием нитрата-диоксида ванадия(V). [Лит.1]
V + 6HNO3 → VO2NO3 + 5NO2 + 3H2O
- Никель растворяется в разбавленной 30% азотной кислоте с образованием нитрата никеля, оксида азота(II) и воды. [Лит.1]
3Ni + 8HNO3 → 3Ni(NO3)2 + 2NO + 4H2O
- Нонагидрат нитрата железа(III) проще всего получать реакцией железа с 50% азотной кислотой. Также он образуется при реакции железа с 20-30% азотной кислотой. Максимально быстро железо растворяется в 35% азотной кислоте - 23600 г/(м2*ч) при 20 С. [Лит.1, Лит.2, Лит.3, Лит.4]
Fe + 4HNO3 + 7H2O → Fe(NO3)3 * 9H2O + NO
- Цинк реагирует с 0,5% азотной кислотой с образованием нитрата цинка, а также преимущественно нитрата аммония и воды. [Лит.1]
4Zn + 10HNO3 (0,5%) → 4Zn(NO3)2 + NH4NO3 + 3H2O
- Цинк реагирует с 6-10% азотной кислотой с образованием нитрата цинка, а также преимущественно азота и воды. [Лит.1, Лит.2]
5Zn + 12HNO3 (6-10%) → 5Zn(NO3)2 + N2 + 6H2O
- Цинк реагирует с 20% азотной кислотой с образованием нитрата цинка, а также преимущественно оксида азота(I) и воды. [Лит.1]
4Zn + 10HNO3 (20%) → 4Zn(NO3)2 + N2O + 5H2O
- Цинк реагирует с концентрированной (68%) азотной кислотой с образованием нитрата цинка, а также преимущественно оксида азота(IV) и воды. [Лит.1, Лит.2]
Zn + 4HNO3 (68%) → Zn(NO3)2 + 2NO2 + 2H2O
- Магний реагирует с концентрированной (68%) азотной кислотой с образованием нитрата магния, преимущественно оксида азота(IV) и воды. [Лит.1]
Mg + 4HNO3 (68%) → Mg(NO3)2 + 2NO2 + 2H2O
- Медь растворяется в 30%-ной азотной кислоте с образованием гексагидрата нитрата меди(II) и оксида азота(II). [Лит.1, Лит.2]
3Cu + 8HNO3(30%) + 14H2O → 3Cu(NO3)2 * 6H2O + 2NO
- Перхлорилбензол нитруется смесью азотной и серной кислот до 3-нитроперхлорилбензола. [Лит.1
 ]
]
C6H5ClO3 + HNO3 → O2NC6H4ClO3 + H2O
- Тетрафторборат нитрония образуется в реакции азотной кислоты с трифторидом бора и фтороводородом. [Лит.1]
- Золото растворяется в серной кислоте в присутствии азотной, иодной кислоты или диоксида марганца. [Лит.1]
- Сульфид ртути(II) растворяется в горячей азотной кислоте. [Лит.1]
- С очень разбавленной (3-5%) азотной кислотой олово образует нитрат олова(II), нитрат аммония и воду. [Лит.1]
- С разбавленным спиртовым раствором азотной кислоты уротропин дает мононитрат уротропина, легко растворимый в воде. [Лит.1]
- С 50-60% водным раствором азотной кислоты уротропин дает осадок динитрата уротропина. [Лит.1]
- Фторид лития растворяется в азотной и серной кислотах при комнатной температуре. [Лит.1]
- При соприкосновении с азотной кислотой самовоспламеняются скипидар и этиловый спирт . [Лит.1]
- Концентрированная азотная кислота воспламеняет растительные материалы (солома, лен, хлопок, стружки). [Лит.1]
- Кумарин нитруется смесью азотной и серной кислот до 6-нитрокумарина с примесью 8-нитрокумарина. [Лит.1]
- Анилин самовоспламеняется через 60 мс контакта с 98% азотной кислотой. [Лит.1]
- N,N-Диметиланилин самовоспламеняется через 0,50 с контакта с 98% азотной кислотой. [Лит.1]
- Метилнитрамин разлагается концентрированной азотной кислотой при 0 С с образованием метилнитрата и закиси азота. [Лит.1]
- Окисление 2-нитротолуола 30% азотной кислотой дает 2-нитробензойную кислоту. Выход 77,2% (при конверсии 57,3 %). [Лит.1]
O2NC6H4CH3 + 2HNO3 → O2NC6H4COOH + 2NO + 2H2O
- Окисление 2-хлортолуола в нитробензоле 30% азотной кислотой дает 2-хлорбензойную кислоту. Выход 79,5% (при конверсии 69,5 %). [Лит.1]
ClC6H4CH3 + 2HNO3 → ClC6H4COOH + 2NO + 2H2O
- Окисление 2-бромтолуола в нитробензоле 30% азотной кислотой дает 2-бромбензойную кислоту. Выход 71,3% (при конверсии 87,6 %). [Лит.1]
BrC6H4CH3 + 2HNO3 → BrC6H4COOH + 2NO + 2H2O
- Окисление 4-бромтолуола в нитробензоле 30% азотной кислотой дает 2-бромбензойную кислоту. Выход 72,5% (при конверсии 89,3 %). [Лит.1]
BrC6H4CH3 + 2HNO3 → BrC6H4COOH + 2NO + 2H2O
- Диоксид селена получают окислением селена азотной кислотой с выпариванием раствора досуха. [Лит.1
 ]
]
Se + 4HNO3 → H2SeO3 + 4NO2 + H2O
H2SeO3 → SeO2 + H2O
- Нитромезитилен образуется при кипячении в течение 1 часа смеси 1 части мезитилена растворенной в 4 частях уксусной кислоты и 1 части дымящей азотной кислоты. Выход 50%. [Лит.1]
(CH3)3C6H3 + HNO3 → (CH3)3C6H2NO2 + H2O
- п-Нитрохлорбензол можно получить нитрованием хлорбензола азотной кислотой. Одновременно образуется о-нитрохлорбензол с меньшим выходом. Выход 68%. [Лит.1
 , Лит.2
, Лит.2 ]
]
C6H5Cl + HNO3 → ClC6H4NO2 + H2O
- п-Нитрохлорбензол можно получить нитрованием хлорбензола смесью азотной и серной кислот. Одновременно образуется о-нитрохлорбензол с меньшим выходом. Выход 55%. [Лит.1
 , Лит.2
, Лит.2 ]
]
C6H5Cl + HNO3 → ClC6H4NO2 + H2O
- Оксид азота(V) получают реакцией безводной азотной кислоты с оксидом фосфора(V) с последующей отгонкой оксида азота(V) в токе кислорода с примесью озона. Выход 50%. [Лит.1
 , Лит.2]
, Лит.2]
2HNO3 + P2O5 → N2O5 + 2HPO3
- Оксид теллура(IV) можно получить окислением теллура азотной кислотой. Выход 84%. [Лит.1
 ]
]
Te + 4HNO3 → TeO2 + 4NO2 + 2H2O
- Фосфорную кислоту можно получить реакцией белого или красного фосфора с 32% азотной кислотой. При более высокой концентрации азотной кислоты реакция слишком бурная. [Лит.1, Лит.2
 , Лит.3
, Лит.3 ]
]
2P + 4HNO3 + H2O → 2H3PO4 + 3NO + NO2
- Безводная хлорная кислота реагирует с безводной азотной кислотой с образованием смеси перхлоратов оксония и нитрония. [Лит.1]
HNO3 + 2HClO4 → NO2ClO4 + H3OClO4
- Оксид хрома(VI) можно получить реакцией хромата бария с азотной кислотой. [Лит.1
 ]
]
BaCrO4 + 2HNO3 → CrO3 + Ba(NO3)2 + H2O
- Сульфид серебра окисляется горячей 30%-ной азотной кислотой с образованием нитрата серебра, серы, оксида азота(II) и воды. [Лит.1, Лит.2]
3Ag2S + 8HNO3 (30%) → 6AgNO3 + 2NO + 3S + 4H2O
- Имидазол легко нитруется смесью азотной и серной кислот с образованием 4(5)-нитроимидазола. Выход 63%. [Лит.1, Лит.2
 ]
] - 2,4-Динитрофенол образуется при нитровании бензола азотной кислотой в присутствии окислов азота и нитрата ртути(II). Выход 57%. [Лит.1
 ]
] - Смесь азотной кислоты с 1,2-дихлорэтаном детонирует от нагрева, удара и трения. [Лит.1]
- 2,3-Дихлор-5,6-дициано-1,4-бензохинон может быть получен окислением 2,3-дицианогидрохинона в соляной кислоте азотной кислотой, тетраоксидом диазота, бромноватой, хромовой или марганцовой кислотами. [Лит.1]
- Сульфид свинца легко растворяется в разбавленной азотной кислоте. [Лит.1]
- 1,2,3,4-Тиатриазол-5-тиол окисляется различными окислителями (иод, трихлорид железа, пероксид водорода, перманганаты, азотная кислота) до ди(1,2,3,4-тиатриазол-5-ил)дисульфида. [Лит.1]
- Ртуть реагирует с избытком концентрированной азотной кислоты с образованием нитрата ртути(II), оксида азота(IV) и воды. [Лит.1]
Hg + 4HNO3 → Hg(NO3)2 + 2NO2 + 2H2O
- Ртуть реагирует с избытком 30% азотной кислоты с образованием нитрата ртути(II), оксида азота(II) и воды. [Лит.1]
3Hg + 8HNO3 (30%) → 3Hg(NO3)2 + 2NO + 4H2O
- Избыток ртути реагирует с 30% азотной кислотой с образованием нитрата ртути(I), оксида азота(II) и воды. [Лит.1]
- В отсутствие растворителя при 0 С кетен реагирует со 100% азотной кислотой с образованием тетранитрометана. Выход 90%. [Лит.1, Лит.2]
4CH2=C=O + 4HNO3 → C(NO2)4 + CO2 + 3CH3COOH
- При температуре от -40 С до -20 С кетен реагирует с дымящей азотной кислотой в дихлорметане с образованием ацетилнитрата с хорошим выходом. [Лит.1]
CH2=C=O + HNO3 → CH3COONO2
Реакции, в которых вещество не участвует:
- В концентрированном виде не реагирует с алюминием, хромом, железом из-за пассивации. [Лит.]
- В концентрированном виде не реагирует с кальцием, барием из-за низкой растворимости их нитратов в концентрированной азотной кислоте. [Лит.]
- Не реагирует с золотом, платиной, родием, иридием, осмием, рутением. [Лит.]
- Из-за пассивации не реагирует с индием, галлием, ниобием, танталом, торием, титаном, цирконием, гафнием, бором. [Лит.]
- Хромо-никелевые стали стойки к разбавленной азотной кислоте. [Лит.]
- К кислоте любой концентрации устойчивы стекло, кварц, фторопласт-4. [Лит.]
- Разбавленная азотная кислота не окисляет иодоводород. [Лит.]
- Золото не реагирует с разбавленными и концентрированными соляной, азотной, фосфорной, мышьяковой и серной кислотами. [Лит.1]
- Золото не растворяется в заметной степени в азотной кислоте. [Лит.1]
- Никель пассивируется концентрированной азотной кислотой. [Лит.1, Лит.2]
- Сульфид ртути(II) не растворим в холодной азотной кислоте. [Лит.1]
- При комнатной температуре титан не растворяется в азотной кислоте любой концентрации. [Лит.1]
- Перхлорилбензол не окисляется следующими реагентами: 3 г перманганата калия в 50 мл воды при 100 С 3 часа; 3 г дихромата натрия в 100 мл 10% серной кислоты при 100 С 3 часа; 70% азотной кислотой при 70-80 С 3 часа; пиросульфатом нитрозила в концентрированной cерной кислоте при 100 С 1 час; 72% хлорной кислотой при 100 С 1 час. [Лит.1]
Показатель преломления (для D-линии натрия):
1,3970 (10,4°C)
Давление паров (в мм рт.ст.):
10 (-4,4°C)
47 (22°C)
60 (26°C)
100 (34,2°C)
Свойства растворов:
0,3296% (вес.), растворитель - вода
Плотность (г/см3) = 1 (20°)
1% (вес.), растворитель - вода
Вязкость (мПа·с) = 1,005 (20°)
Плотность (г/см3) = 1,0037 (20°)
Температура замерзания (°C) = -0,56
1,255% (вес.), растворитель - вода
Плотность (г/см3) = 1,005 (20°)
2,164% (вес.), растворитель - вода
Плотность (г/см3) = 1,01 (20°)
4% (вес.), растворитель - вода
Вязкость (мПа·с) = 1,014 (20°)
Плотность (г/см3) = 1,0202 (20°)
Температура замерзания (°C) = -2,32
5% (вес.), растворитель - вода
Плотность (г/см3) = 1,0256 (20°)
10% (вес.), растворитель - вода
Динамическая вязкость (мПа·с) = 1,044 (20°)
Плотность (г/см3) = 1,0543 (20°)
Показатель преломления для D-линии натрия = 1,346 (20°)
Температура замерзания (°C) = -6,6
10,12% (вес.), растворитель - вода
Плотность (г/см3) = 1,055 (20°)
12% (вес.), растворитель - вода
Вязкость (мПа·с) = 1,058 (20°)
Плотность (г/см3) = 1,066 (20°)
Температура замерзания (°C) = -8,27
13,9% (вес.), растворитель - вода
Температура замерзания (°C) = -10
15,9% (вес.), растворитель - вода
Коэффициент активности = 0,909 (25°)
20% (вес.), растворитель - вода
Плотность (г/см3) = 1,115 (20°)
24,8% (вес.), растворитель - вода
Электропроводность (мСм/см) = 767,6 (18°)
25,48% (вес.), растворитель - вода
Плотность (г/см3) = 1,15 (20°)
30% (вес.), растворитель - вода
Плотность (г/см3) = 1,18 (20°)
31% (вес.), растворитель - вода
Электропроводность (мСм/см) = 781,9 (18°)
31,5% (вес.), растворитель - вода
Температура замерзания (°C) = -40
32,7% (вес.), растворитель - вода
Температура замерзания (°C) = -43
32,94% (вес.), растворитель - вода
Плотность (г/см3) = 1,2 (20°)
40% (вес.), растворитель - вода
Моляльность (моль/кг растворителя) = 10,58
Молярность (моль/л раствора) = 7,913
Плотность (г/см3) = 1,2463 (20°)
Температура замерзания (°C) = -30
48,42% (вес.), растворитель - вода
Плотность (г/см3) = 1,3 (20°)
50% (вес.), растворитель - вода
Плотность (г/см3) = 1,31 (20°)
53,8% (вес.), растворитель - вода
Температура замерзания (°C) = -18,5
60% (вес.), растворитель - вода
Плотность (г/см3) = 1,3667 (20°)
64,74% (вес.), растворитель - вода
Плотность (г/см3) = 1,39 (20°)
65% (вес.), растворитель - вода
Плотность (г/см3) = 1,3913 (20°)
68,1% (вес.), растворитель - вода
Плотность (г/см3) = 1,405 (20°)
69,7% (вес.), растворитель - вода
Температура замерзания (°C) = -40
70% (вес.), растворитель - вода
Плотность (г/см3) = 1,4134 (20°)
70,5% (вес.), растворитель - вода
Температура замерзания (°C) = -42
71,63% (вес.), растворитель - вода
Плотность (г/см3) = 1,42 (20°)
72,5% (вес.), растворитель - вода
Температура замерзания (°C) = -40
75% (вес.), растворитель - вода
Плотность (г/см3) = 1,4337 (20°)
77,75% (вес.), растворитель - вода
Температура замерзания (°C) = -38
80% (вес.), растворитель - вода
Плотность (г/см3) = 1,4521 (20°)
82,4% (вес.), растворитель - вода
Температура замерзания (°C) = -40
85% (вес.), растворитель - вода
Плотность (г/см3) = 1,4686 (20°)
89,95% (вес.), растворитель - вода
Температура замерзания (°C) = -66,3
90% (вес.), растворитель - вода
Плотность (г/см3) = 1,4826 (20°)
91,9% (вес.), растворитель - вода
Температура замерзания (°C) = -60
94,8% (вес.), растворитель - вода
Температура замерзания (°C) = -50
95,46% (вес.), растворитель - вода
Плотность (г/см3) = 1,495 (20°)
99,01% (вес.), растворитель - вода
Плотность (г/см3) = 1,509 (20°)
Показатели диссоциации:
H0 (1) = -6 (25°C, вода)
H0 (1) = -3,78 (20°C, вода, 65% водный раствор)
pKa (1) = -1,64 (25°C, вода)
pKa (1) = 3,57 (25°C, этанол)
pKa (1) = 3,17 (25°C, метанол)
pKa (1) = 9,38 (25°C, уксусная кислота)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-174,1 (ж)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-80,8 (ж)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
155,6 (ж)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
109,9 (ж)Энтальпия плавления ΔHпл (кДж/моль):
10,47Стандартная энтальпия образования ΔH (298 К, кДж/моль)
-134,306 (г) [Лит.]
Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль)
-73,964 (г) [Лит.]
Стандартная энтропия S (298 К, Дж/(моль·K))
266,475 (г) [Лит.]
Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K))
53,495 (г) [Лит.]
Дополнительная информация::
При поглощении азотной кислотой диоксида азота образуется нитроолеум - дымящая жидкость желтоватого цвета, сильный окислитель. Азотная кислота, содержащая 30% NO2 при давлении 100 кПа кипит при 38 С, а содержащая 40% NO2 - при 29 С. При этом в парах содержится 96,5% окислов азота и 3,5% паров азотной кислоты. Бесцветная кислота при хранении быстро желтеет из-за распада до диоксида азота.
Растворяет серебро, ртуть, медь с образованием нитратов этих металлов и выделением NO или NO2. С металлами стоящими до водорода азотная кислота дает продукты ее восстановления - нитрат аммония, азот, оксид азота(I), оксид азота(II), оксид азота(IV); соотношение выделяющихся продуктов зависит от активности металла и концентрации кислоты. При определенных концентрациях кислоты и подборе металлов можно получить водород. Смесь азотной и соляной кислот называется "царской водкой" и растворяет золото и платину.
Разбавленная азотная кислота не окисляет иодоводород, концентрированная - окисляет. Кипящая кислота окисляет серу до серной кислоты, уголь и многие органические вещества - до углекислого газа.
Азотная кислота является сильной одноосновной кислотой. С основными оксидами, основаниями и солями слабых кислот образует растворимые в воде соли, называемые нитратами.
Источники информации:
- Armarego W. L. F. Purification of Laboratory Chemicals. - 5ed. - 2003. - С. 445
- CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010. - С. 5-13
- Holleman A.F., Wiberg E., Wiberg N. Lehrbuch der Anorganischen Chemie. - Berlin: Walter de Gruyter, 1995. - С. 244
- Seidell A. Solubilities of inorganic and metal organic compounds. - 3ed., vol.1. - New York: D. Van Nostrand Company, 1940. - С. 582-583
- Вредные вещества в промышленности: Справочник для химиков, инженеров и врачей. - 7-е изд., Т.3. - Л.: Химия, 1976. - С. 117-118
- Мельников Е.Я., Салтанова В.П., Наумова А.М., Блинова Ж.С. Технология неорганических веществ и минеральных удобрений. - М.: Химия, 1983. - С. 138-139
- Некрасов Б.В. Основы общей химии. - Т.1. - М.: Химия, 1973. - С. 416-418, 427-430
- Неорганическая химия. - Под ред. Третьякова Ю.Д., Т.2. - М.: Academa, 2004. - С. 196-201
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 51
- Реми Г. Курс неорганической химии. - Т.1. - М., 1963. - С. 642-647
- Справочник азотчика. - М.: Химия, 1987. - С. 18-141
- Справочник химика. - 2 изд., Т. 2. - Л.-М.: Химия, 1964. - С. 12-13
- Справочник химика. - 2 изд., Т.1. - Л.-М.: Химия, 1966. - С. 607
- Химическая технология неорганических веществ. - Кн.1, под ред. Ахметова Т.Г. - М.: Высшая школа, 2002. - С. 490-549
- Химическая энциклопедия. - Т. 1. - М.: Советская энциклопедия, 1988. - С. 61-63
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер