Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
пропан-1,2,3-триол
Синонимы и иностранные названия:
1,2,3-пропантриол (рус.)
glycerol (англ.)
глицерин (рус.)
глицерол (рус.)
пропантриол-1,2,3 (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. жидкостьБрутто-формула (по системе Хилла для органических веществ):
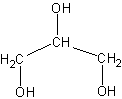
C3H8O3Формула в виде текста:
HOCH2CH(OH)CH2OHМолекулярная масса (в а.е.м.): 92,09
Температура плавления (в °C):
20Температура кипения (в °C):
290Температура разложения (в °C):
290Температурные константы смесей (содержание в весовых процентах):
-40 °C (температура плавления эвтектической смеси) 2-гидрокси-N,N,N-триметилэтанаминия хлорид 43,1% пропан-1,2,3-триол 56,9%
Растворимость (в г/100 г растворителя или характеристика):
аммиак жидкий: смешивается [Лит.]
ацетон: хорошо растворим [Лит.]
бензин: не растворим [Лит.]
бензол: не растворим [Лит.]
вода: смешивается [Лит.]
диметилсульфоксид: смешивается [Лит.]
диэтиловый эфир: 0,25 [Лит.]
метанол: смешивается [Лит.]
метиламин: легко растворим [Лит.]
петролейный эфир: не растворим [Лит.]
сероуглерод: не растворим [Лит.]
сульфолан: смешивается [Лит.]
тетрахлорметан: не растворим [Лит.]
углекислый газ жидкий: 0,05 [Лит.]
фтороводород: легко растворим [Лит.]
хлороформ: не растворим [Лит.]
этанол: смешивается [Лит.]
этилацетат: 9 [Лит.]
Плотность:
1,2604 (20°C, г/см3, состояние вещества - жидкость)
Некоторые числовые свойства вещества:
Год открытия: 1779 (Шееле)
Объем производства (тонн/год): 158900 (в США, в 1979 г.)
Объем производства (тонн/год): 610000 (в мире, в 1994 г.)
Сладость по отношению к 2% раствору сахарозы: 0,48
Метод получения 1:
Источник информации: Шёнберг А. Препаративная органическая фотохимия. - М.: ИИЛ, 1963 стр. 12810 г (1 моль) аллилового спирта смешивают в кварцевом сосуде с 10%-ной перекисью водорода (1,05 моля) и освещают светом ртутной лампы (Cooper — Hewitt) при интенсивном встряхивании (100 колебаний в минуту). После облучения в течение 160 час смесь теряет 89% первоначального содержания перекиси. Продукт реакции подвергают фракционированной перегонке и получают 6,8 г вещества с т. кип. 287—289°.
Лампу устанавливают на расстоянии 50 см от реакционного сосуда, вблизи которого для наиболее полного использования облучения расположен рефлектор из алюминия. Чтобы температура реакционной смеси не поднималась выше комнатной, сосуд охлаждают воздушным вентилятором.
Способы получения:
- В промышленности получают реакцией аллилового спирта с пероксидом водорода в присутствии вольфрамовой кислоты и последующей гидратацией образующегося глицидола в присутствии серной кислоты. [Лит.]
- В промышленности получают гидролизом эпихлоргидрина в водной эмульсии в присутствии карбоната натрия (80 С, 0,6-1 МПа). [Лит.]
- Гидролизом триацетилглицерина, получаемого из ацетата серебра и 1,2,3-трибромпропана. [Лит.]
- Гидролизом природных жиров. [Лит.]
Используется для синтеза веществ:
1,2-O-изопропилиденглицерин
1,3-дихлорпропан-2-ол
2-иодпропан
3-хлорпропан-1,2-диол
проп-2-ен-1-ол
пропеналь
Реакции вещества:
- Дихроматом калия в серной кислоте окисляется до углекислого газа и воды. [Лит.]
3HOCH2CHOHCH2OH + 7K2Cr2O7 + 28H2SO4 → 9CO2 + 7Cr2(SO4)3 + 7K2SO4 + 40H2O
- Количественно окисляется иодной кислотой до муравьиной кислоты и формальдегида. [Лит.]
- При реакции с сухим хлороводородом дает 3-хлорпропан-1,2-диол. [Лит.]
- При длительном нагревании при 250-280 С в слабощелочной среде дает смесь полиглицеринов. [Лит.]
- При нагревании в присутствии водоотнимающих катализаторов (гидросульфата калия, сульфата магния, борной кислоты) дает акролеин. [Лит.]
- Реагирует с ацетоном давая кеталь. [Лит.]
- С хлорсульфоновой кислотой образует ди- и трисульфат глицерина. [Лит.]
- При смешивании с избытком концентрированной серной кислотой дает α-глицеринсерную кислоту. [Лит.]
- При нагревании с калием или натрием дает глицераты по одной гидроксильной группе. [Лит.]
- При нагревании до 120-145 С (для отгонки образующейся воды) с гидроксидом натрия дает глицерат натрия. [Лит.]
- Реагирует с оксидом кальция с образованием глицерата кальция по двум гидроксигруппам. [Лит.]
- Реагирует с оксидом свинца(II) с образованием глицерата свинца по двум гидроксигруппам. [Лит.]
- Под действием иодоводородной кислоты образует 2-иодпропан. [Лит.]
- Водородом под давлением при нагревании в присутствии катализаторов восстанавливается до 1,2-пропиленгликоля. [Лит.]
- Реагирует с фосфорной кислотой с образованием смеси двух изомерных глицерофосфорных кислот. [Лит.]
- При контакте с сухим перманганатом калия самовоспламеняется. [Лит.]
- Реагирует со смесью азотной и серной кислот на холоду с образованием тринитрата глицерина. [Лит.]
- При действии перекиси водорода в присутствии солей железа(II) окисляется в смесь глицеринового альдегида и 1,3-дигидроксиацетона. [Лит.]
- Концентрированной азотной кислотой окисляется до глицериновой кислоты. [Лит.]
- При энергичном окислении глицерина перманганатом калия образуются тартроновая и мезоксалевые кислоты, которые при нагревании декарбоксилируются с образованием гликолевой и глиоксалевой кислот. [Лит.]
- Под действием кислорода воздуха в присутствии гидроксида бария при 65 С окисляется до смеси щавелевой и муравьиной кислот. [Лит.]
- Хинолин получают реакцией ацетанилида с глицерином в серной кислоте в присутствии нитробензола и сульфата железа(II). Выход 90%. Название реакции: реакция Скраупа. [Лит.1
 ]
] - Мочевина реагирует при 130 C в присутствии катализаторов (сульфата цинка, сульфата магния и др.) с глицерином с образованием глицеринкарбоната. Выход 81% (с сульфатом цинка; без катализатора выход 41% при 140 С). [Лит.1, Лит.2]
- Пероксид натрия воспламеняет глицерин, ледяную уксусную кислоту, молочную кислоту, параформальдегид, миндальное масло и диэтиловый эфир. [Лит.1]
- Пероксид натрия воспламеняет ацетон, этилацетат, глицерин и изобутанол если они содержат небольшое количество воды. [Лит.1]
Реакции, в которых вещество не участвует:
- При 150 С не окисляется оксидом селена(IV). [Лит.]
Показатель преломления (для D-линии натрия):
1,4729 (20°C)
Давление паров (в мм рт.ст.):
1 (125,5°C)
9 (166°C)
10 (167,2°C)
20 (182°C)
40 (198°C)
100 (220,1°C)
400 (263°C)
Свойства растворов:
10% (вес.), растворитель - вода
Динамическая вязкость (мПа·с) = 1,31 (20°)
Плотность (г/см3) = 1,0215 (20°)
Показатель преломления для D-линии натрия = 1,3448 (20°)
Температура замерзания (°C) = -2,32
15% (вес.), растворитель - вода
Температура замерзания (°C) = -3,1
30% (вес.), растворитель - вода
Температура замерзания (°C) = -9,4
40% (вес.), растворитель - вода
Динамическая вязкость (мПа·с) = 3,73 (20°)
Плотность (г/см3) = 1,0984 (20°)
Показатель преломления для D-линии натрия = 1,3841 (20°)
Температура замерзания (°C) = -15,2
48% (вес.), растворитель - вода
Плотность (г/см3) = 1,12 (20°)
50% (вес.), растворитель - вода
Температура замерзания (°C) = -23
52% (вес.), растворитель - вода
Плотность (г/см3) = 1,1308 (20°)
60% (вес.), растворитель - вода
Плотность (г/см3) = 1,153 (20°)
Температура замерзания (°C) = -34,4
66,7% (вес.), растворитель - вода
Температура замерзания (°C) = -46,52
70% (вес.), растворитель - вода
Температура замерзания (°C) = -38,8
80% (вес.), растворитель - вода
Плотность (г/см3) = 1,2085 (20°)
Температура замерзания (°C) = -20,4
88% (вес.), растворитель - вода
Плотность (г/см3) = 1,2299 (20°)
90% (вес.), растворитель - вода
Температура замерзания (°C) = -1,6
96% (вес.), растворитель - вода
Динамическая вязкость (мПа·с) = 648 (20°)
Плотность (г/см3) = 1,2508 (20°)
Показатель преломления для D-линии натрия = 1,4674 (20°)
Показатели диссоциации:
pKa (1) = 13,99 (25°C, вода)
Диэлектрическая проницаемость:
42,5 (25°C)
Дипольный момент молекулы (в дебаях):
0,28 (20°C)
Динамическая вязкость жидкостей и газов (в мПа·с):
945 (25°C)
Поверхностное натяжение (в мН/м):
62,5 (25°C)
Скорость звука в веществе (в м/с):
1895 (20°C, состояние среды - жидкость)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-669,6 (ж)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
206,3 (ж)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
218,9 (ж)Энтальпия кипения ΔHкип (кДж/моль):
88,12Температура вспышки в воздухе (°C):
174Температура воспламенения на воздухе (°C):
187Температура самовоспламенения на воздухе (°C):
393Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-577,9 (г)Энтальпия кипения ΔHкип (кДж/моль)
61 (ж) [Лит.]
Некоторые нечисловые свойства вещества:
гигроскопичное вещество
Летальная доза (ЛД50, в мг/кг):
28000 (крысы, внутрижелудочно)
Применение:
Придает винам мягкость вкуса. Используется в косметических средствах как смягчающее и успокаивающее средство. Добавляется в зубные пасты, клеи и кондитерские изделия для предотвращения их высыхания. Как пластификатор целлофана.
Этимология названия:
От греческого glykys - сладкий.
Источники информации:
- Armarego W. L. F. Purification of Laboratory Chemicals. - 5ed. - 2003. - С. 252
- CRC Handbook of Chemistry and Physics. - 90ed. - CRC Press, 2010. - С. 5-25
- Seidell A. Solubilities of organic compounds. - 3ed., vol.2. - New York: D. Van Nostrand Company, 1941. - С. 209-210
- Бирун А.М. Практикум по органической химии. - М., 1961. - С. 53
- Гурвич Я.А. Справочник молодого аппаратчика-химика. - М.: Химия, 1991. - С. 182-183 (промышленное получение)
- Девяткин В.В., Ляхова Ю.М. Химия для любознательных, или о чем не узнаешь на уроке. - Ярославль: Академия Холдинг, 2000. - С. 44-45
- Маркман А.Л. Химия липидов. - Вып. 2. - Ташкент: Издательство ФАН Узбекской ССР, 1970. - С. 102-150
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 141
- Рахманкулов Д.Л., Кимсанов Б.Х., Чанышев Р.Р. Физические и химические свойства глицерина. - М.: Химия, 2003
- Токсикологический вестник. - 2004. - №3. - С. 38 (летальная доза)
- Химическая энциклопедия. - Т. 1. - М.: Советская энциклопедия, 1988. - С. 585
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер