Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
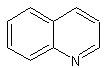
Свойства вещества:
хинолин
Синонимы и иностранные названия:
quinoline (англ.)
бензопиридин (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. маслянистая жидкостьБрутто-формула (по системе Хилла для органических веществ):
C9H7NМолекулярная масса (в а.е.м.): 129,16
CAS №: 91-22-5
Температура плавления (в °C):
-15,6Температура кипения (в °C):
237,7Растворимость (в г/100 г растворителя или характеристика):
ацетон: смешивается [Лит.]
бензол: смешивается [Лит.]
вода: 6 (20°C) [Лит.]
диэтиловый эфир: смешивается [Лит.]
пентакарбонил железа: не растворим [Лит.]
сероуглерод: смешивается [Лит.]
сульфолан: смешивается [Лит.]
этанол: смешивается [Лит.]
Плотность:
1,095 (20°C, г/см3, состояние вещества - жидкость)
Некоторые числовые свойства вещества:
Год открытия: 1834
Метод получения 1:
Источник информации: Лабораторные работы по органическому синтезу. - М.: Просвещение, 1979 стр. 229-230В круглодонную колбу емкостью 300 мл, снабженную обратным холодильником, помещают исходные вещества в следующем порядке: 2,5 г сульфата железа (II) (FeSO4.7H2O); 33,8 мл глицерина; 10,8 мл свежеперегнанного анилина; 7,1 мл нитробензола и 20 мл концентрированной серной кислоты. Смесь тщательно перемешивают и осторожно нагревают на горелке с сеткой до кипения, после чего нагревание прекращают, так как реакция идет за счет значительного саморазогревания. После прекращения кипения продолжают нагревание еще в течение 2,5 ч и охлаждают до 100°С. Переносят смесь в круглодонную колбу емкостью 500 мл и отгоняют непрореагировавший нитробензол с водяным паром. Перегонку ведут до исчезновения маслянистых капель в дистилляте. Затем в реакционную смесь добавляют 52,5 мл 40%-ного раствора гидроксида натрия и вновь ведут перегонку с водяным паром, отгоняя образовавшийся хинолин вместе с непрореагировавшим анилином. Дистиллят подкисляют 14 мл концентрированной серной кислоты. Охлаждают до 0°С и избыток анилина диазотируют 10%-ным раствором нитрита натрия. Полноту реакции диазотирования контролируют по иодкрахмальной бумажке и конго бумаге. После окончания диазотирования реакционную колбу нагревают на водяной бане до прекращения выделения азота.
Смесь подщелачивают концентрированным раствором гидроксида натрия и хинолин вновь перегоняют с водяным паром. Дистиллят экстрагируют эфиром. Эфирную вытяжку сушат твердым гидроксидом натрия. Эфир отгоняют. Остаток перегоняют в колбе с воздушным холодильником, собирая фракцию с температурой кипения 237°С. Выход 10 г.
Хинолин — бесцветная жидкость. Мало растворяется в воде, растворяется в спирте и эфире. Температура плавления —19,5°С; температура кипения 237,7°С; 105—110°С (10 мм рт. ст.); d = 1,095; n = 1,6280.
Способы получения:
- Реакцией о-аминобензальдегида с ацетальдегидом в присутствии гидроксида натрия. [Лит.]
- Реакцией 2-метиланилина с глиоксалем в присутствии гидроксида натрия при 150 С. (выход 35-40%) [Лит.]
- Нагревание N-ацетил-N-метиланилина с хлоридом цинка. [Лит.]
- Хинолин получают реакцией ацетанилида с глицерином в серной кислоте в присутствии нитробензола и сульфата железа(II). Выход 90%. Название реакции: реакция Скраупа. [Лит.1
 ]
]
Реакции вещества:
- Реагирует с амидом калия и нитратом калия в жидком аммиаке с образованием 2-аминохинолина. [Лит.]
- При 256-330 С окисляется серной кислотой в присутствии селена в никотиновую кислоту. (выход 75%) [Лит.]
- Электролитическим окислением хинолина на платиновом аноде в 75% серной кислоте получается пиридин-2,3-дикарбоновая кислота. (выход 77%) [Лит.]
- Окисляется перекисью водорода в серной кислоте в присутствии сульфата меди(II) с образованием пиридин-2,3-дикарбоновой кислоты. (выход 70%) [Лит.]
- Реагирует с бромидом фенилмагния в смеси эфира и диоксана с образованием 2-фенилхинолина. (выход 44%) [Лит.]
- Сульфируется 30% олеумом при 90 С в течение 40 часов с образованием хинолин-8-сульфокислоты. (выход 54%) [Лит.]
- Нитруется диоксидом азота при 95-100 С с образованием 7-нитрохинолина. (выход 11%) [Лит.]
- Восстанавливается водородом над никелевым катализатором при 210 С под давлением 70 атм до декагидрохинолина. (выход 62%) [Лит.]
- Восстанавливается оловом и соляной кислотой до 1,2,3,4-тетрагидрохинолина. [Лит.]
- Окисляется щелочным раствором перманганата калия с образованием пиридин-2,3-дикарбоновой кислоты. [Лит.]
- Восстанавливается цинком в соляной кислоте. [Лит.]
- С галогеналканами и алкилсульфатами дает четвертичные соли по азоту. [Лит.]
- Окисляется оксидом марганца(IV) в серной кислоте с образованием пиридин-2,3-дикарбоновой кислоты. [Лит.]
- С бутиллитием образует смесь 2- и 4-бутилхинолинов. [Лит.]
- При нагревании с сухим гидроксидом калия при 250-260 С образует 2-гидроксихинолин. [Лит.]
- Хлорируется в запаяной трубке хлором при 400 С в присутствии пентахлорида сурьмы с образованием гексахлорбензола и гексахлорэтана. [Лит.]
- Реагирует с бромцианом. [Лит.]
- При реакции с гипохлоритом кальция и борной кислотой, с последующим кипячением с щелочью, образуется карбостирил. [Лит.]
- Нитруется смесью азотной и серной кислот с образованием смеси 5- и 8-нитрохинолинов. [Лит.]
- Сульфируется концентрированной серной кислотой при 300 С с образованием хинолин-6-сульфокислоты. [Лит.]
- Нитруется смесью нитрата лития с уксусным ангидридом с образованием 7-нитрохинолина с плохим выходом. [Лит.]
- При действии надкислот образует N-окись. [Лит.]
- Реагирует с хлоруксусной кислотой с образованием внутренней четвертичной соли (бетаина). [Лит.]
- Восстанавливается водородом над скелетным никелевым катализатором в спирте при комнатной температуре под давлением 1-3 атм до 1,2,3,4-тетрагидрохинолина. [Лит.]
- Реагирует с диметиловым эфиром ацетилендикарбоновой кислоты. [Лит.]
- Восстанавливается до 1,2-дигидрохинолина диизобутилалюминийгидридом при 0-10 С. (выход 95%) [Лит.]
- Восстанавливается до 1,2,3,4-тетрагидрохинолина диизобутилалюминийгидридом при кипячении. (выход 70%) [Лит.]
Показатель преломления (для D-линии натрия):
1,6268 (20°C)
Давление паров (в мм рт.ст.):
10 (108,8°C)
17 (114°C)
Показатели диссоциации:
pKBH+ (1) = 4,94 (20°C, вода)
Индекс удерживания для газовой хроматографии:
1237,4 (фаза колонки - DB-5, со скоростью подъема температуры 6 К/мин)
Диэлектрическая проницаемость:
9 (25°C)
Дипольный момент молекулы (в дебаях):
2,29 (20°C)
Поверхностное натяжение (в мН/м):
45 (20°C)
Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
199,2 (ж)Энтальпия плавления ΔHпл (кДж/моль):
10,8Теплота сгорания (кДж/моль):
4700,7Некоторые нечисловые свойства вещества:
гигроскопичное вещество
Дополнительная информация::
Перегоняется с водяным паром.
Источники информации:
- Armarego W. L. F. Purification of Laboratory Chemicals. - 5ed. - 2003. - С. 347
- Yalkowsky S.H., Yan H. Handbook of aqueous solubility data. - CRC Press, 2003. - С. 550
- Альберт А., Сержент Е. Константы ионизации кислот и оснований. - М.-Л.: Химия, 1964. - С. 140
- Гетероциклические соединения. - Т. 4, Под ред. Эльдерфилда Р. - М.: ИИЛ, 1955. - С. 5-218
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 192
- Химическая энциклопедия. - Т. 5. - М.: Советская энциклопедия, 1999. - С. 267-268
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер