Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
галлий
Синонимы и иностранные названия:
gallium (англ.)
Вещество входит в группы:
металлы
Тип вещества:
неорганическое
Внешний вид:
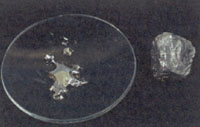
серебристо-бел. ромбические кристаллы металла
Фотографии вещества:
Брутто-формула (по системе Хилла для органических веществ):
GaФормула в виде текста:
GaМолекулярная масса (в а.е.м.): 69,72
Температура плавления (в °C):
29,78Температура кипения (в °C):
2205Температурные константы смесей (содержание в весовых процентах):
3 °C (температура плавления эвтектической смеси) галлий 61% индий 25% олово серое (α-форма) 13% цинк 1%
5 °C (температура плавления эвтектической смеси) галлий 62% индий 25% олово серое (α-форма) 13%
13 °C (температура плавления эвтектической смеси) галлий 67% индий 29% цинк 4%
15,73 °C (температура плавления эвтектической смеси) галлий 24,8% индий 75,2%
18 °C (температура плавления эвтектической смеси) галлий 99,5% кремний кристаллический 0,5%
20 °C (температура плавления эвтектической смеси) галлий 92% олово белое β-форма 8%
25 °C (температура плавления эвтектической смеси) галлий 95% цинк 5%
27,3 °C (температура плавления эвтектической смеси) галлий 99,5% таллий 0,5%
Растворимость (в г/100 г растворителя или характеристика):
вода: не растворим [Лит.]
ртуть: 0,13 (-38,87°C) [Лит.]
ртуть: 0,85 (10°C) [Лит.]
ртуть: 1,1 (20°C) [Лит.]
ртуть: 1,75 (65°C) [Лит.]
ртуть: 2,22 (95°C) [Лит.]
тетрабромгаллат(III) галлия(I): 2,4 (180°C) [Лит.]
Плотность:
5,904 (29,6°C, г/см3, состояние вещества - кристаллы)
6,095 (29,8°C, г/см3, состояние вещества - жидкость)
6,08 (52,9°C, г/см3, состояние вещества - жидкость)
6,041 (102°C, г/см3, состояние вещества - жидкость)
6,005 (149°C, г/см3, состояние вещества - жидкость)
5,972 (200°C, г/см3, состояние вещества - жидкость)
5,905 (301°C, г/см3, состояние вещества - жидкость)
5,84 (402°C, г/см3, состояние вещества - жидкость)
5,779 (500°C, г/см3, состояние вещества - жидкость)
5,72 (600°C, г/см3, состояние вещества - жидкость)
5,604 (800°C, г/см3, состояние вещества - жидкость)
5,492 (1010°C, г/см3, состояние вещества - жидкость)
5,445 (1110°C, г/см3, состояние вещества - жидкость)
Некоторые числовые свойства вещества:
Год открытия: 1875 (Лекок де Буабодран П.)
Критическая температура сверхпроводимости (атмосферное давление, массивные образцы, в К): 1,091
Критическое магнитное поле разрушения сверхпроводимости (атмосферное давление, массивные образцы, при 0 К, в Тл): 0,00594
Твердость по шкале Мооса: 1,5 - 2,5
Реакции вещества:
- Растворяется в царской водке. [Лит.]
- При комнатной температуре медленно растворяется в азотной кислоте. Быстрее растворение идет в горячей кислоте. [Лит.]
- Растворяется в щелочах. [Лит.]
- При -35 С реагирует с бромом. [Лит.]
- Реагирует с иодом при нагревании. [Лит.]
- При комнатной температуре реагирует с фтором и хлором. [Лит.]
- При нагревании реагирует с серой. [Лит.]
- При 900 С а атмосфере аммиака образует нитрид. [Лит.]
- Растворяется в концентрированной плавиковой кислоте. [Лит.]
- При комнатной температуре медленно растворяется в серной кислоте. [Лит.]
- При комнатной температуре медленно растворяется в соляной кислоте. [Лит.]
- Хлорид галлия(III) получают реакцией галлия с сухим хлороводородом. [Лит.1
 ]
]
2Ga + 6HCl → 2GaCl3 + 3H2
- Галлий быстро растворяется в горячей концентрированной хлорной кислоте с образованием перхлората галлия. [Лит.1]
- Гексагидрат перхлората галлия(III) получают растворением галлия в 72% хлорной кислоте. [Лит.1
 ]
]
Реакции, в которых вещество не участвует:
- Не разрушает бериллий до 600 С, вольфрам до 800 С, рений до 700 С, ниобий и тантал до 400-450 С, осмий до 500 С, рутений и иридий до 500 С, ванадий, гафний и титан до 400-450 С. [Лит.]
- Плавленный кварц выдерживает действие галлия при 1160 С в течение нескольких сотен часов. [Лит.]
- Оксид бериллия устойчив к галлию до 1000 С, оксид алюминия - до 1000 С, нитрид алюминия - до 1300 С, фторопласт - до 250 С. [Лит.]
- Не реагирует с чистым и сухим кислородом до 260 С. [Лит.]
- Не реагирует с кипящей водой, свободной от кислорода. [Лит.]
- Непосредственно не реагирует с водородом и азотом. [Лит.]
- Графит устойчив к действию галлия до 800 С. [Лит.]
- Стекло пирекс устойчиво к действию галлия до 500 С. [Лит.]
Периоды полураспада:
6031Ga = 70 мс (β+ (100%), β+p (1,6%), β+α (менее 0,023%))
6131Ga = 167 мс (β+ (100%), β+p (менее 0,25%))
6231Ga = 116,121 мс (β+ (100%))
6331Ga = 32,4 с (β+ (100%))
6431Ga = 2,627 мин (β+ (100%))
64m31Ga = 21,9 мкс (изотопный переход (100%))
6531Ga = 15,2 мин (β+ (100%))
6631Ga = 9,304 ч (β+ (100%))
6731Ga = 3,2617 дня (захват электрона (100%))
6831Ga = 67,845 мин (β+ (100%))
6931Ga = стабилен ( (содержание в природной смеси изотопов 60,108%))
7031Ga = 21,14 мин (β- (около 100%), захват электрона (0,41%))
7131Ga = стабилен ( (содержание в природной смеси изотопов 39,892%))
7231Ga = 14,025 ч (β- (100%))
72m31Ga = 39,68 мс (изотопный переход (100%))
7331Ga = 4,86 ч (β- (100%))
7431Ga = 8,12 мин (β- (100%))
74m31Ga = 9,5 с (изотопный переход (75%), β-)
7531Ga = 126 с (β- (100%))
7631Ga = 32,6 с (β- (100%))
7731Ga = 13,2 с (β- (100%))
7831Ga = 5,09 с (β- (100%))
78m31Ga = 110 нс (изотопный переход (100%))
7931Ga = 2,848 с (β- (100%), β-n (0,089%))
8031Ga = 1,9 с (β- (100%), β-n (0,86%))
8131Ga = 1,217 с (β- (100%), β-n (11,7%))
8231Ga = 599 мс (β- (100%), β-n (21,3%))
82m31Ga = 93,5 нс (изотопный переход (100%))
8331Ga = 308,1 мс (β- (100%), β-n (62,8%))
83m31Ga = 120 нс (изотопный переход (100%))
8431Ga = 85 мс (β- (100%), β-n (40%))
8531Ga = 92,2 мс (β- (100%), β-n (более 35%))
8631Ga = 47 мс (β- (100%), β-n (60%), β-2n (20%))
Давление паров (в мм рт.ст.):
0,000000001 (519°C)
0,00000001 (567°C)
0,1 (1180°C)
1 (1350°C)
10 (1570°C)
100 (1870°C)
Стандартный электродный потенциал:
Ga3+ + e- → Ga2+, E = -0,63 (вода, 25°C)
Ga3+ + 3e- → Ga, E = -0,53 (вода, 25°C)
Динамическая вязкость жидкостей и газов (в мПа·с):
2,037 (30°C)
1,894 (52,9°C)
1,612 (97,7°C)
1,604 (102°C)
1,406 (149°C)
1,243 (203°C)
1,029 (301°C)
0,8858 (402°C)
0,8113 (500°C)
0,7705 (600°C)
0,5783 (1100°C)
Поверхностное натяжение (в мН/м):
358 (30°C)
Удельная теплоемкость при постоянном давлении (в Дж/г·K):
0,41 (30-100°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
0 (т)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
0 (т)Стандартная энтропия вещества S (298 К, Дж/(моль·K)):
41,1 (т)Стандартная мольная теплоемкость Cp (298 К, Дж/(моль·K)):
26,1 (т)Энтальпия кипения ΔHкип (кДж/моль):
256Природные и антропогенные источники:
Накапливается в листьях яблони, груши и тополя, траве василька.
Дополнительная информация::
Ограниченно растворяет ртуть, не растворяет щелочные металлы. Легко сплавляется с алюминием, резко уменьшая его механическую прочность и химическую устойчивость.
Применение вещества:
- в производстве полупроводников [Лит.]
- для получения оптических зеркал специального назначения [Лит.]
- легирующая добавка к магнию [Лит.]
- теплоноситель [Лит.]
Дополнительная информация:
Электронная конфигурация атома 1s22s22p63s23p63d104s24p1.
В жидком виде имеет более высокую плотность и электропроводность, чем в твердом. При охлаждении может переохлаждатся до -40 С. Жидкий галлий из-за оксидной пленки смачивает стекло.
При повышении давления температура плавления галлия падает.
Жидкий галлий резко уменьшает прочность монокристаллов цинка, олова.
Галлий легко сплавляется с медью, поэтому при высокой температуре жидкий галлий разъедает твердую медь. При высокой температуре разъедает твердую платину и другие платиновые металлы.
Источники информации:
- Гурвич Я.А. Справочник молодого аппаратчика-химика. - М.: Химия, 1991. - С. 50
- Девяткин В.В., Ляхова Ю.М. Химия для любознательных, или о чем не узнаешь на уроке. - Ярославль: Академия Холдинг, 2000. - С. 35
- Дымов А.М., Савостин А.П. Аналитическая химия галлия. - М.: Наука, 1958. - С. 5-13
- Иванова Р.В. Химия и технология галлия. - М.: Металлургия, 1973
- Некрасов Б.В. Основы общей химии. - Т.2. - М.: Химия, 1973. - С. 59-62
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 60
- Редкие и рассеянные элементы. Химия и технология. - Кн. 3. - М.: Мисис, 2003. - С. 23-30
- Руководство по неорганическому синтезу. - Т.6, под ред. Брауэра Г. - М.: Мир, 1986. - С. 2175
- Справочник по растворимости. - Т.1, Кн.1. - М.-Л.: ИАН СССР, 1961. - С. 595
- Успехи химии. - 1997. - Т.66, №2. - С. 112
- Федоров П.И., Мохосоев М.В., Алексеев Ф.П. Химия галлия, индия и таллия. - Новосибирск: Наука, 1977. - С. 7-12
- Химическая энциклопедия. - Т. 1. - М.: Советская энциклопедия, 1988. - С. 479-481
- Химический энциклопедический словарь. - Под ред. Кнунянц И.Л. - М.: Советская энциклопедия, 1983. - С. 117
- Шека И.А., Чаус И.С., Митюрева Т.Т. Галлий. - Киев: Государственное издательство технической литературы УССР, 1963
- Энциклопедия для детей. - Т.17: Химия. - М.: Аванта+, 2004. - С. 206
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер