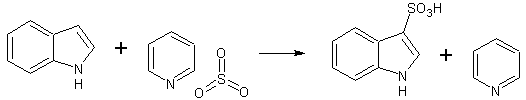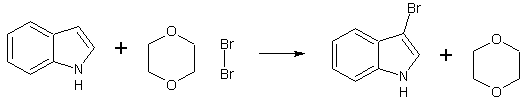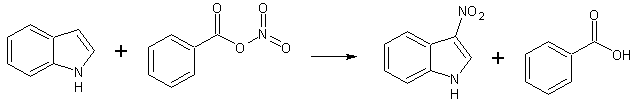Главная страница
 Базы данных
Базы данных
 База данных свойств веществ (поиск)
База данных свойств веществ (поиск)
Свойства вещества:
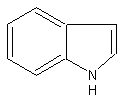
индол
Синонимы и иностранные названия:
1H-indole (англ.)
2,3-бензпиррол (рус.)
Тип вещества:
органическое
Внешний вид:
бесцветн. листовидные кристаллыБрутто-формула (по системе Хилла для органических веществ):
C8H7NМолекулярная масса (в а.е.м.): 117,15
Температура плавления (в °C):
52,5Температура кипения (в °C):
254Растворимость (в г/100 г растворителя или характеристика):
бензол: растворим [Лит.]
вода: 0,3558 (25°C) [Лит.]
диэтиловый эфир: легко растворим [Лит.]
лигроин: растворим [Лит.]
метанол: растворим [Лит.]
хинолин: 11,39 (20°C) [Лит.]
этанол абсолютный: 35,85 (20°C) [Лит.]
Плотность:
1,22 (20°C, г/см3, состояние вещества - кристаллы)
Вкус, запах, гигроскопичность:
запах: экскрементов
Метод получения 1:
Источник информации: Жунгиету Г.И., Суворов Н.Н., Кост А.Н. Новые препаративные синтезы в индольном ряду. - Кишинев: Штиинца, 1983 стр. 4Через вертикально установленный трубчатый реактор длиной 230 мм и внутренним диаметром 17 мм снабженный электрообогревом и карманом с термопарой и заполненный 50 мл катализатора (75 мас% Al2O3, 25 мас% MgF2, активированный перед процессом прогревом при 500-600 С) непрерывно при атмосферном давлении пропускают 20% толуольный раствор фенилгидразона ацетальдегида со скоростью 25 мл/ч и азот высокой степени чистоты со скоростью около 3 л/ч. Раствор фенилгидразона ацетальдегида и азот подают в верхнюю часть реактора на слой катализатора, а продукты реакции выводят из нижней части через холодильник, охлаждаемый проточной водой. Температура в средней части слоя катализатора 270 С.
Процесс синтеза индола ведут при полной конверсии фенилгидразона ацетальдегида до появления в катализате следво фенилгидразона (0,1-0,2%). В результате за 33 часа непрерывной работы до проскока фенилгидразона собирают 570 г катализата, в котором по данным ГЖХ, содержится 14,5% индола и 2,3% анилина.
Выход индола (из расчета на пропущенный фенилгидразон ацетальдегида) 75%.
После отгонки толуола и разгона остатка на ректификационной колонке эффективностью 10 теоретических тарелок получают технический индол с содержанием основного вещества 99,0% и т.пл. 49-50 С. Выход технического индола, выделенного методом ректификации составляет 71% (из расчета на фенилгидразон ацетальдегида). После перекристаллизации из петролейного эфира т.пл. 52-53 С.
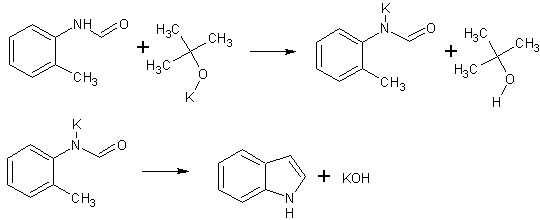
Метод получения 2:
Источник информации: Синтезы органических препаратов. - Ч. 3. - М., 1952 стр. 258-259
Трехгорлую круглодонную колбу емкостью 2 л снабжают обратным холодильником и стеклянной трубкой для ввода газа, которую присоединяют к баллону с азотом. Третье горло колбы закрыто пробкой. Верхнюю часть холодильника соединяют с ловушкой, которая состоит из двух колб для отсасывания емкостью по 500 мл, соединенных последовательно. Первая колба пуста; вторая содержит 100 мл парафинового масла, причем вводная трубка в этой колбе оканчивается несколько ниже поверхности масла.
В реакционную колбу помещают 600 мл продажного трет-бутилового спирта (можно использовать и другие спирты, но выходы ниже) и вытесняют из нее воздух сухим азотом. Затем к спирту прибавляют по частям 29 г (0,75 грамм-атома) металлического калия. Смесь нагревают на водяной бане до тех пор, пока не растворится весь калий, после чего прибавляют 68 г (0,5 моля) N-формил-о-толуидина и переводят его в раствор. Обратный холодильник меняют на обращенный вниз; в качестве приемника применяют колбу для отсасывания. Приемник предохраняют от доступа воздуха, соединяя его с ловушкой, которая применялась в начале процесса. Реакционную колбу погружают в металлическую баню и избыток спирта отгоняют. Остаток нагревают около 20 мин. до 350-360 С (при этом выделяются горючие газы), затем ему дают охладиться в токе азота. Остаток разлагают, прибавляя к нему 300 мл воды, и смесь перегоняют с водяным паром, чтобы отделить индол. Дистиллят экстрагируют последовательно 300 мл и 100 мл эфира и соединенные вместе эфирные вытяжки взбалтывают с холодным разбавленным раствором 5% -ной соляной кислоты для удаления остатков о-толуидина. Эфирные вытяжки промывают 100 мл воды, затем 100 мл 5%-ного раствора соды и сушат над 20 г сернокислого натрия. Эфир отгоняют и остаток перегоняют в вакууме. Индол переходит при 142-144°С (27 мм.рт.ст.) [128°С (10 мм.рт.ст.), 121 С (5 мм.рт.ст.)] в виде бледно-желтого масла, которое затвердевает, а затем плавится при 52-53°С.
Выход составляет 23 г (79% теоретич.). Выход после перекристаллизации из смеси 100 мл петролейного и 10 мл диэтилового эфиров составляет 21 г.
Способы получения:
- 3-Хлориндол при кипячении с 57% иодоводородной кислотой и красным фосфором в течение 4 часов дает индол. Выход 82 - 86%. [Лит.1]
Используется для синтеза веществ:
2-(1H-индол-3-ил)этанамин
индол-3-карбальдегид
Реакции вещества:
- Сульфируется комплексом оксида серы(VI) и пиридина с образованием индол-3-сульфокислоты. [Лит.]
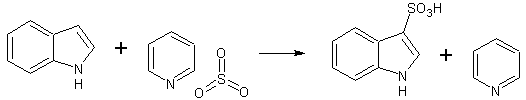
- Бромируется комплексом брома с диоксаном с образованием 3-броминдола. [Лит.]
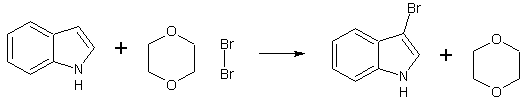
- Реагирует с бензоилнитратом в отсутствие кислот с образованием 3-нитроиндола. [Лит.]
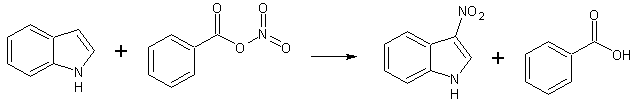
- Конденсируется с формальдегидом и диметиламином с образованием 3-(диметиламинометил)индола. (выход 100%) [Лит.]
- Реагирует с гидросульфитом натрия в водно-спиртово-эфирной среде с образованием индолин-2-сульфоната натрия, который может быть пробромирован, прохлорирован, прииодирован или пронитрован по положению 5. (выход 68%) [Лит.]
- Реагирует с 2-(N-ацетиламино)этанолом в присутствии бис(пентаметилциклопентадиенил)тетрахлородииридия и карбоната цезия с образованием N-ацетилтриптамина. (выход 60%) [Лит.]
- Реагирует с раствором амида натрия в жидком аммиаке давая натриевую соль (по индольному азоту), которая реагирует с метилиодидом с образованием N-метилиндола. (выход 85%) [Лит.]
- Хлорируется сульфурилхлоридом с образованием 3-хлориндола. [Лит.]
- Иодируется водным раствором трииодида калия с образованием 3-иодиндола. [Лит.]
- Реагирует с нитритом натрия в уксусной кислоте давая смолу, содержащую два нитрозированных бис-индола, соединенных положениями 2 и 3. [Лит.]
- При нагревании с хлороформом и водным раствором гидроксида натрия образует индол-3-карбальдегид. (выход 31%) [Лит.]
- Индол ацилируется уксусным ангидридом в присутствии хлорида алюминия в течение 10 часов с образованием 3-ацетилиндола. Выход 78%. [Лит.1]
- Индол ацилируется дихлорангидридом янтарной кислоты в присутствии хлорида олова(IV) в течение 10 часов с образованием, полсе гидролиза) 4-(индол-3-ил)-4-оксобутановой кислоты. Выход 72%. [Лит.1]
- Индол-3-карбоновую кислоту получают реакцией индола с натрием с углекислым газом. Выход 18,5%. [Лит.1
 , Лит.2
, Лит.2 ]
] - Нитропруссид натрия в водном растворе дает фиолетовую окраску с индолом. [Лит.1]
Показатели диссоциации:
pKBH+ (1) = -2,4 (25°C, вода)
pKa (1) = 17 (25°C, вода)
Летальная доза (ЛД50, в мг/кг):
1000 (крысы, перорально)
Природные и антропогенные источники:
Содержится в экскрементах в количестве 10-40 мг/кг.
Дополнительная информация::
Нитрование в сильно кислых средах приводит к полимерам. Формилируется по Вильмейеру-Хааку.
Источники информации:
- Blunt J.W., Munro M.H.G. Dictionary of marine Natural Products. - Chapman and Hall/CRC, 2008. - С. 1192
- Seidell A. Solubilities of organic compounds. - 3ed., vol.2. - New York: D. Van Nostrand Company, 1941. - С. 575
- Yalkowsky S.H., Yan H. Handbook of aqueous solubility data. - CRC Press, 2003. - С. 462
- Грандберг И.И. Органическая химия: Учеб. для студ. вузов, обучающихся по агроном. спец.. - 4-е изд. - М.: Дрофа, 2001. - С. 526
- Общая органическая химия. - Т. 8, под ред. Бартона Д. и Оллиса В.Д. - М.: Химия, 1985. - С. 488-531
- Рабинович В.А., Хавин З.Я. Краткий химический справочник. - Л.: Химия, 1977. - С. 150
- Справочник коксохимика. - Т. 3. - Харьков: ИНЖЭК, 2009. - С. 354-357
- Справочник по растворимости. - Т.1, Кн.2. - М.-Л.: ИАН СССР, 1962. - С. 1510
- Химическая энциклопедия. - Т. 2. - М.: Советская энциклопедия, 1990. - С. 232-233
Если не нашли нужное вещество или свойства можно выполнить следующие действия:
Если вы нашли ошибку на странице, выделите ее и нажмите Ctrl + Enter.
© Сбор и оформление информации: Руслан Анатольевич Кипер