
Растворяют (при нагревании до 50°) 10 г гидрохинона в 200 мл воды; раствор охлаждают до 20°, затем медленно приливают к нему 10 г концентрированной серной кислоты и снова охлаждают до 20°. Перемешивая и охлаждая (температура не выше 30°), прибавляют раствор 28 г бихромата натрия в 13 мл воды до тех пор, пока окраска осадка (хингидрон) из темно-зеленой не перейдет в желтовато-зеленую. После этого реакционную смесь охлаждают до 10°, отсасывают кристаллы иа воронке Бюхнера и промывают их небольшим количеством холодной воды. Фильтрат 3 раза извлекают бензолом, беря каждый раз по 20 мл.
Соединенные бензольные вытяжки переносят в коническую колбу, прибавляют хинон, ранее собранный на фильтре, и нагревают при перемешивании на водяной бане до полного растворения хинона. Бензольный раствор сушат еще в горячем состоянии небольшим количеством хлористого кальция и через короткое время фильтруют.
Бензол отгоняют до тех пор, пока не начнется перегонка хинона. При охлаждении остатка в перегонной колбе хиной выкристаллизовывается. Бензол нужно отгонять медленно во избежание уменьшения выхода хинона (унос с парами бензола).
Выход 8—9 г (80—90% от теоретического).
Перегонка хинона с водяным паром всегда сопровождается его заметным разложением.
К раствору 23 г (0,25 моля) анилина в смеси 100 мл чистой концентрированной серной кислоты и 500 мл воды, находящемуся в толстостенном стакане, постепенно приливают из капельной воронки (при охлаждении снаружи льдом и перемешивании) раствор 30 г бихромата натрия в 75 мл воды. Температура при этом не должна подниматься выше 10°. Реакционную смесь оставляют стоять в течение ночи в холодном месте, а на следующее утро таким же способом к ней приливают по каплям раствор 40 г бихромата натрия в 120 мл воды. Снова оставляют стоять в течение 6 час, после чего раствор (окрашенный в темно-коричневый цвет) фильтруют на большой воронке Бюхнера и промывают осадок на фильтре небольшим количеством воды. Фильтрат 2 раза экстрагируют эфиром (применяя каждый раз по 0,5 л последнего).
Эфир отгоняют из перегонной колбы (из которой затем производят перегонку хинона с водяным паром); отогнанным эфиром (разделив его на две порции) снова извлекают хинон из уже обработанного фильтрата и снова отгоняют его из той же перегонной колбы.
К сырому хинону, оставшемуся в колбе после отгонки эфира, присоединяют остаток на фильтре (вместе с фильтром) и отгоняют хинон с водяным паром.
Хинон выделяется из погона в виде красивых золотисто-желтых кристаллов; его сушат сначала между листами фильтровальной бумаги, а затем в обыкновенном эксикаторе над хлористым кальцием.
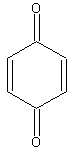
Температура плавления чистого хинона 116°C.
Выход 14—16 г.
Хинон легко возгоняется; пары его имеют едкий запах и вызывают слезоточение. Ввиду большой летучести хинон нельзя долгое время оставлять на воздухе.
Для перекристаллизации хинона можно применять спирт или петролейный эфир. Чистый сухой препарат сохраняется без разложения длительное время.
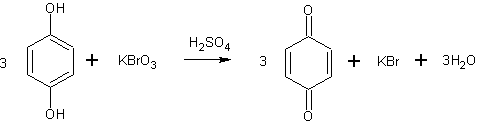
В круглодонную колбу вносят 10 г гидрохинона и 100 мл воды, нагретой до 50 °С. После растворения гидрохинона раствор охлаждают до 20 °С и медленно, небольшими порциями прибавляют 5 мл серной кислоты, выполняющей роль катализатора.
В случае применения не совсем чистого гидрохинона сразу же после внесения серной кислоты образуется черный клейкий осадок. Для освобождения от этого осадка жидкость фильтруют череа складчатый фильтр еще до внесения окислителя, в данном случае бромноватокислого калия
В реакционную смесь осторожно вносят 5,5 г бромноватокислого калия, нагревая колбу на водяной бане до 60°С. Сразу же начинается реакция с образованием зеленовато-черного осадка — хингидрона.
Подогревание прекращают, так как температура самопроизвольно повышается до 75°С. Реакция окисления считается законченной, как только черный цвет реакционной массы изменится до ярко-желтого цвета бензохинона. Реакционную смесь нагревают при 80 °С до полного растворения бензохинона, затем охлаждают до 0°С. Выпавший пара-бензохинон отфильтровывают на воронке Бюхнера, промывают небольшим количеством ледяной воды и сушат.
Выход п-бензохинона (т. пл. 116 °С) около 8 г.
Летуч с водяным паром.
Легко и обратимо восстанавливается водородом (катализатор диоксид платины), диоксидом серы, гидразином - до гидрохинона (через анион-радикал - семихинон). Образует прочные комплексы с переносом заряда с бензолом, толуолом, нафталином, антраценом, гидрохиноном (хингидрон) - в соотношении 1:1, с фенолом - в соотношении 1:1 и 1:2 (фенохинон). Действием порошка цинка в уксусном ангидриде превращается в диацетоксибензол.
С первичными аминами образует замещенные монохинонимины, с гидроксиламином - п-хинонмоноокисм (таутомер п-нитрозофенола) и п-хинондиоксим. При взаимодействии с реактивами Гриньяра превращается в хинолы, перегруппировывающиеся в алкилгидрохиноны.
Подобно ненасыщенным кетонам способен к присоединению по кратным связям. Продукты присоединения окисляются избытком исходного хинона, если их окислительно-восстановительный потенциал ниже, чем у хинона. С метанолом образует 2,5-диметокси-1,4-бензохинон (катализатор хлорид цинка), с анилином - 2,5-дианилино-1,4-бензохинон. С тиомочевиной в соляной кислоте образует 2-(1,1-диаминометилтио)-1,4-бензохинон, который превращается либо в 2-оксо-5-гидрокси-1,3-бензоксатиолан или, избытком бензохинона - в 2-амино-6-гидрокси-1,3-бензтиазол. Специфической реакцией для хинонов является ацетоксилирование по Тиле-Винтеру, где из бензохинона под действием уксусного ангидрида образуется 1,2,4-триацетоксибензол.
В реакции Дильса-Альдера выступает как диенофил.
Реагирует с фенилдиазонийхлоридом давая 2-фенил-1,4-бензохинон.
С перекисью водорода в щелочной среде образует эпоксигидрохинон, превращающийся в кислой среде в гидроксихинон. Устойчив к действию окислителей.
Облучение 1,4-бензохинона в растворе дает с низким выходом димер. Облучение 1,4-бензохинона в присутствии альдегидов приводит с умеренными выходами или к моноэирам гидрохинона (ароматические альдегиды, альфа, бета-ненасыщенные альдегиды) или к к 2-ацилгидрохинону (алифатические и ароматические альдегиды).